07. Седьмой барьер защиты. В- и Т-лимфоциты.
Самое сложное в описании иммунных механизмов ответа организма на внешние и внутренние угрозы – это функционирование клеточного иммунитета. Проблема заключается в том, что множество иммунных клеток постоянно перемещаются по всему организму с током крови и лимфы, но местами задерживаются в тех или иных органах и меняют свои свойства. Тем более всё оказывается сложнее, что иммуноциты могут заменять друг друга, и их защитные эффекты многократно дублируются. Словно по мановению волшебства иммуноциты выставляют на своей поверхности разные молекулы рецепторов, и дальше те же самые клетки начинают функционировать именно по программам этих молекул, обозначаемых наукой как кластер дифференцировки CD (англ. cluster of differentiation) под номерами 1, 2, 3 и так далее. Наконец, сверхсложная задача – описать естественное течение событий, связанных с ранним синтезом В-клетками антител и ситуации с поздним Т-клеточным ответом. Этот подраздел медицинской науки окутал плотный туман, отчасти в связи с невозможностью описания иммунных сетей взаимовлияния
молекул, особенно слабого понимания хронологии событий, отчасти с огромным количеством рассуждений, не привязанных к практике врачевания. Сделаем ещё одну попытку на основе научных данных нарисовать модель некоторых аспектов клеточного иммунитета, хорошо понимая, что общая картина медицине не вполне ясна.
7.1. Саногенез и клеточный иммунитет
Пытаясь воспроизвести реальный ход иммунобиологических событий, мы неизбежно затронем один из коренных вопросов медицины. В настоящее время лечащий врач учитывает при диагностике заболеваний и формировании тактики лечения, как правило, патогенез заболевания. Однако, по замыслу Алексея Николаевича Кокосова, нужно начинать обращать внимание и на саногенез, механизмы самовосстановления, заложенные природой в каждом человеке [1]. Благодаря такому подходу практика врача может приобрести новый вид:
- Начинается анализ естественных саногенетических механизмов организма человека.
- Выявляются факторы, подавляющие саногенез и предпринимается поиск методов как избежать, по возможности, их использования.
- Появляется необходимость в поддержке саногенеза методами традиционной медицины.
Описание механизмов клеточного иммунитета рассмотрим как последовательность иммунных событий во времени. С точки зрения хронологии развития инфекционного процесса и вирусоносительства первый эшелон обороны клеточного иммунитета это первая неделя врожденного иммунитета; второй эшелон обороны это вторая и последующие недели приобретенного иммунитета; третий эшелон – пожизненный, он включает клетки памяти, долгоживущие плазматические клетки, иккосомы (запасники антигенов) и микробиоту.
7.2. Обзор механизмов клеточного иммунитета
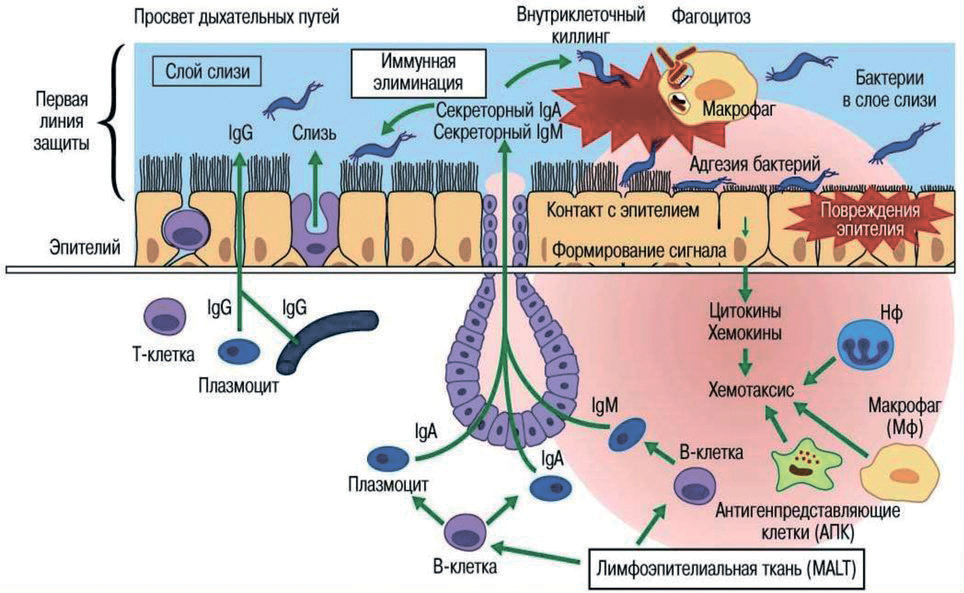
Слизистые человеческого организма – пищеварительной, дыхательной, глазной и мочеполовой систем выстланы биопленкой, которая у всех здоровых людей состоит из вирусов, микробов, простейших и грибков. Они являются постоянными жителями слизистых, и к ним каждый год присоединяются новые штаммы и виды микроорганизмов, которые попали из окружающего пространства – с едой, водой, воздухом и телесными контактами. Всего клеточных микроорганизмов на 30 триллионов клеток здорового человека в полтора-два раза больше [2], а количество вирусов более 400 триллионов. Только в образцах кала человека в норме содержится около 108-109 вирусов на 1 грамм [3].
Под пленкой на базальной мембране располагаются эпителиальные клетки, которые выделяют множество противовирусных и противомикробных веществ. В основном организм от патогенов защищает реснитчатый эпителий, это подробнее описано в главе 1. В собственной оболочке слизистой хозяина проникновения патогенных микроорганизмов ожидают нейтрофилы, макрофаги, лимфоциты и дендритные клетки. Они постоянно тестируют микроокружение и, либо уничтожают патогены сразу, в первые сутки, либо перерабатывают и представляют их молекулы-эпитопы для второй линии иммунной защиты второй недели – приобретенного иммунитета.
7.2.1. Первый эшелон обороны.
Фагоциты, киллеры и В-лимфоциты С первых минут появления микроорганизмов, не имеющих на поверхности сигналов «Я-свой» (молекул главного комплекса гистосовместимости МГКГ = MHC-Major Histocompatibility Complex,), их уничтожают естественные киллеры. Вместе с ними уничтожаются собственные клетки, пораженные вирусами или мутировавшие, потому что они, занятые синтезом ненужных элементов, теряют способность выставлять на поверхности рецептор
«Я-свой».

Кроме того, фагоцитами поглощаются клетки, которые имеют на поверхности рецепторы «Я-чужой». Это патоген-ассоциированные образы молекул (PAMP – pathogen-associated molecular patterns), либо молекулярные образы внутренней опасности (опухоли, поврежденные клетки)
damage associated molecular patterns, DAMPs. В первые часы защиту осуществляют нейтрофилы (микрофаги), затем отработавших нейтрофилов пожирают макрофаги. Однако, для работы фагоцитов необходима энергия кислорода. Взаимодействие образ-распознающего рецептора с патогеном приводит к активации клетки. В течение первых секунд после активации нейтрофилы, например, резко увеличивают поглощение кислорода, образуются активные формы кислорода. Респираторный взрыв обеспечивает внутриклеточное уничтожение патогенов. [4]. К процессу молниеносной защиты, в который вовлечены эпителиоциты, естественные киллеры и нейтрофилы, присоединяются В- и Т-лимфоциты. Поскольку первые три группы клеток мы рассмотрели в 5 и 6 главах, рассмотрим далее В- и Т-лимфоцитарные реакции. В-лимфоциты имеют в диаметре 9,5 мкм, ворсинчатую поверхность за счет иммуноглобулиновых (Ig) рецепторов, которые погружены в липидный бислой мембраны В-клеток и свободно перемещаются по мембране. Наличие на поверхности В-лимфоцитов иммуноглобулиновых молекул для распознавания антигена (рецепторов BCR) является их основной характеристикой.
Синтез иммуноглобулиновых рецепторов происходит в В-лимфоцитах постоянно (50% рецепторных молекул обновляется в течение 4-6 часов). Рецептор BCR содержит мономерный IgM, который присутствует на поверхности всех зрелых В-клеток, и поверхностный IgD [5].
Рецепторы представляют собой молекулы, выставляющиеся клетками на свою поверхность с целью взаимодействовать с другими клетками, либо растворённые в крови или тканевой жидкости вещества. Выставленные на мембране рецепторы, пронизывая её насквозь, передают снаружи внутрь через мембрану клетки различные сигналы. И что самое интересное, большинство рецепторов клеток человека представляют собой заякоренные на мембранах иммуноглобулины=антитела [6]. Белковые молекулы с высокой чувствительностью распознают друг на друге некие специальные поверхности (по типу выступ-впадина), образуются очень прочные комплексы [7].
Это означает, что большинство случаев взаимодействий между клетками можно представить следующим образом: «рецепторы=антитела=иммуноглобулины». Две клетки сближаются друг с другом, подходящая молекула одной клетки вставляется в рецептор другой клетки как ключ в замок. Ключ с момента совпадения стереохимических структур называется лигандом [8]. Так что ключом-лигандом могут «заводиться» любые процессы в другой клетке. Но при условии, если «ключ» подходит к «замку».
По-латински ligare означает связывать. И лигандами и рецепторами могут быть антитела как растворимые, так и заякоренные на мембране клеток. Заякоренные могут «сползать» с поверхно
сти клеток и переходить в растворимую форму. Часто встреча и контакт двух клеток можно описать взаимодействием молекул поверхности «рецептор=антитело=иммуноглобулин=лиганд». Что одному лиганд, то другому антитело (рецептор). Образование сложных сетей антител и рецепторов в человеческом организме, по мнению Александра Борисовича Полетаева, быстро меняет иммунную картину каждый день, каждый час, каждое мгновение и пока малодоступно расшифровке [9].
Все клоны, образующие популяцию В-клеток, формируют антигенный репертуар В-лимфоцитов. Этот репертуар, как правило, обеспечивает распознавание практически всех возможных конфигураций молекул (эпитопов) [10] на протяжении жизни человека. Последние открытия в иммунологии сильно изменили мнение исследователей о врожденном иммунитете. «В1-лимфоциты могут секретировать естественные антитела независимо от поступления патогенов. Значительная часть этих антител направлена против распространённых эпитопов патогенных микроорганизмов» [11]. То есть организм заранее знает о внешних угрозах и защищен врождённым иммунитетом.
По-видимому, образам патогенности внешнего мира уже существуют внутри макроорганизма соответствующие стереохимические структуры, распознающие их. При внедрении часть патогенов связывается с рецепторами BCR на В-лимфоцитах в виде встроенных в мембрану антител IgM и IgD.
Установлено, что в течение 5–6 дней, которые уходят на развитие приобретенного иммунного ответа (второго эшелона), пока ещё без участия специфически обученных Т-лимфоцитов, в первом эшелоне уже образуется клон В-клеток, которые в течение одного дня продуцируют до 100 триллионов антител IgM, специфических к данному патогену, если он обладает повторяющимися антигенными детерминантами.
Однако иммунологическая память IgM-антителозависимого ответа пока ещё отсутствует. Вопреки распространяющемуся мнению о том, что иммуноглобулины G «важнее», подсчитано, что агглютинирующая и комплементсвязывающая способности антител IgM в сотни раз более выражены, чем у IgG [12]. После связывания антигена В-клеточным рецептором В-лимфоциты меняют внутреннюю структуру, размножаются и превращаются в плазматические клетки – эффекторные В-лимфоциты, секретирующие антитела, которые имеют ту же специфичность к антигену, что и В-клеточный рецептор на исходном В-лимфоците. Таким образом, антиген, тот самый, активировавший В-лимфоцит, становится мишенью для антител, продуцируемых потомками В-лимфоцита, с которым он случайно встретился [13]. Как говорится, не буди спящего зверя…

У дочерних плазматических клеток, в отличие от материнских В-клеток, хорошо развит секреторный аппарат, что позволяет им синтезировать и секретировать несколько тысяч молекул антител в секунду [14]. Такая продуктивность сочетается с короткой продолжительностью жизни: плазматические клетки секретируют антитела в регионарных лимфоузлах и селезёнке в среднем до 5дней [15].
7.2.2. Второй эшелон обороны: приобретенный иммунитет
Формирование второго эшелона клеточной обороны начинается с тестирования. Различные иммунные клетки, способные тестировать свое микроокружение и потом представлять эпитопы антигенов для Т-лимфоцитов, следующие: эпителиоциты, нейтрофилы, макрофаги, В-лимфоциты и дендритные клетки. Они способны к фагоцитозу и называются антигенпредставляющими клетками (АПК). Чаще всего антигены представляют дендритные клетки. Необходимость в представлении Т-клеткам информации другими иммуноцитами АПК связана с тем, что важное действующее лицо второго эшелона обороны, Т-лимфоцит, не может принимать сигналы от цельного антигена, большой белковой молекулы или участков стенок бактерий. Он может стимулироваться только очень малыми кусочками белков – короткими пептидами, их называют эпитопы.

Тестируя микроокружение, незрелые дендритные клетки через М-клетки эпителия или между клеток эпителия протискивают свои псевдоподии и поглощают патогены, либо патогены поглощаются М-клеткой и попадают к подлежащим им дендритным клеткам (ДК) [16].
Фагоцитоз (заглатывание) патогенов дендритными клетками обеспечивают рецепторы-мусорщики SR (scavenger receptors).Небольшой, но постоянный поток ДК из ткани с приносящей лимфой в лимфатические узлы идет постоянно, но при возникновении инфекции и воспаления этот небольшой поток клеток превращается в настоящее наводнение.

Перемещение ДК из ткани в лимфатический узел проходит в несколько этапов: мобилизация, открепление, движение в межклеточном матриксе, проникновение в лимфатический сосуд и
перемещение в региональный лимфатический узел. Простагландин ПГЕ2 активирует цинкависимые
ферменты матриксные металлопротеиназы MMP, которые помогают дендритной клетке образовать проходы в межклеточном матриксе и протиснуться в лимфатический сосуд [17]. Внутри лимфатических сосудов ДК пассивно перемещаются с током лимфы со скоростью около 5-10 см/мин [18].
Через каждый лимфатический узел за 1 час проходит около 1 миллиарда лимфоцитов [19]. А между тем в него попадают антигены внешнего мира не только в составе фагоцитов АПК, но и в свободном плавании. Лимфу в некотором смысле можно назвать канализацией нашего организма. Точно так же эти свободные антигены захватываются фагоцитами (ДК, макрофаги, В-лимфоциты) внутри лимфатических узлов. Их тоже переваривают, перерабатывают и выставляют на своей поверхности в качестве возможных ключиков-лигандов ко включению очередного попавшегося лимфоцита с комплементарным рецептором на инициацию образования клона против этого антигена. Либо выставляют на поверхности целиком.
Этот процесс занимает 4-6 суток с момента распознавания антигена. Таким образом, приобретенный Т-клеточный иммунный ответ можно наблюдать не ранее чем через неделю после первого попадания антигена в организм [20].
7.2.2.1. Подробнее о Т-клеточном ответе
Считается, что после миграции в лимфоидную ткань одна зрелая ДК, нагруженная антигеном, в течение 1 часа может вступать в контакт с 5000 Т-лимфоцитов, что повышает шансы на случайную
встречу подобных друг другу молекул [21]. Но антиген должен быть представлен сообществу Т-лимфоцитов молекулой главного комплекса гистосовместимости (МГКГ), для чего он должен стать эпитопом малого размера, потому что щель паратопа рецепторов TCR малого размера. В период движения к месту передачи информации в лимфоузле ДК внутри них происходит обработка антигена путем разрезания больших частей на малые – пептиды, которые будут служить эпитопами, то есть представляющими признаки патогена – антигенными детерминантами (процессинг). Переваривание совершают протеасомы, разрезающие белок, например, вирусной частицы, на короткие цепи пептидов в среднем по 8-10 аминокислот. Такой размер оптимально ложится
в расщелину рецепторов ГКГ I (щель Бьоркмана), либо для МГКГ II по 10-25 аминокислот.
[22]. Белки теплового шока шапероны обеспечивают контроль правильного сворачивания
белков ГКГ в шероховатой эндоплазматической сети.
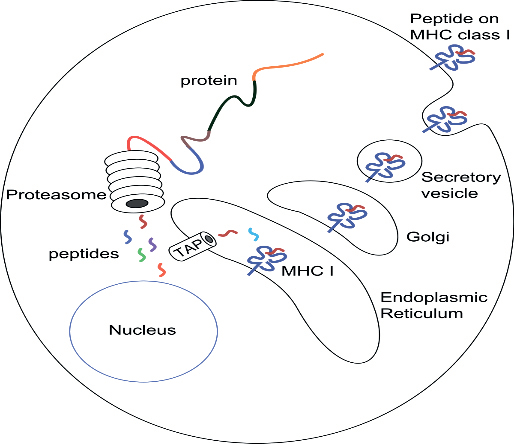
После попадания пептида от белка вируса в расщелину МГКГ, они вместе переносятся в комплекс Гольджи и выставляются в виде рецептора на поверхности дендритной клетки [23].
Большинство белков внутри клетки переваривается до отдельных аминокислотных остатков, которые превращаются в питание самой клетки. Почему некоторые превращаются в иммунногенные короткоцепочечные пептиды? Недопереваренные участки белков транспортируются в эндоплазматическую сеть транспортным комплексом TAP (transporter associated with antigen processing). В эндоплазматической сети пептиды связываются с пептидосвязывающей щелью МГКГ I в α-цепи, если позволяет структура боковых цепей в их аминокислотной последовательности. Сначала с α-цепью связываются белки-шапероны, далее они контролируют процесс. Два или три кармана на каждой молекуле ГКГ вмещают в себя только определенные молекулы-остатки, называемые якорными. Более оптимальны для энергии связывания NH3-пептидCOO положения Р2 и Р9. Пептиды, имеющие в этих положениях другие аминокислотные остатки, также могут связаться, но с меньшим сродством [24].
Всю человеческую жизнь лимфоциты постоянно находятся в состоянии, напоминающем естественный отбор, когда активируются, пролиферируют и дифференцируются в действующие клетки только те, которые связали свой антиген с рецептором для антигенов. Наличие такого селективного механизма иммунного ответа впервые предположил Фрэнк Макфарлейн Бернет, за клонально-селекционную теорию иммунитета удостоенный Нобелевской премии. Клетки начинают делиться, в результате образуется множество клеток-потомков, то есть клонов. Это явление назвали экспансией клонов [25]. Но для начала необходимо главное событие – встреча. Если ключ «готов» и выставлен дендритной клеткой для тестирования, тогда и только тогда активируется Т-лимфоцит, из которого образуется весь клон с одним и тем же рецептором.
Для подготовки данного события задолго до встреч с контактёрами формируется множество вариантов лимфоцитов с той или иной конфигурацией «замков». Творцом словно заранее создаются в человеческом теле все возможные варианты паратопов для эпитопов макромира. А некоторые антигены придут к ин- дивидууму только через десятилетия (!). История образования принимающих рецепторов TCR для будущих «гостей» состоит в следующем. Потомки стволовых клеток с током крови попадают в вилочковую железу, этот костно-мозговой тип предшественников при- надлежит популяции с паспортной характеристикой Lyn- Sca-1+c-kithi Thy1.1- Он имеет молекулы слипания, которые тормозят циркулирующие предшественники именно в сосудах вилочковой железы. Выйдя из кровеносного русла, клетки остаются в железе для подготовки к выполнению функции. Процесс выброса из костного мозга в тимус предшественников лимфоцитов происходит волнами с периодичностью в месяц-полтора. В тимусе предшественники способны преобразоваться в Т- и В-лимфоциты, естественные киллеры, дендритные клетки и NKT-клетки. В корково-медулярной зоне предшественники делятся в цикле DN1 в течение 7-10 дней, затем двигаются вглубь коры, где на стадии дифференцировки DN2 уже необратимо преобразуются в Т-линию клеток.
В вилочковой железе происходит перестройка генов с целью достижения их максимального разнообразия. Кстати, у В-лимфоцитов реаранжировка генов происходит подобным образом, но раньше, в костном мозге, давая множество вариантов рецепторов BCR. Тимоциты делятся, выставляют на поверхности рецепторы TCR и оба корецептора CD4 и CD8. Они называются дваждыпозитивными, стадия преобразования так и обозначена DP – Duble Positive. Этих лимфоцитов в тимусе до 90%, они преобразовываются далее, проходя отбор, позитивную селекцию, вступая в контакт с эпителиальными клетками стромы коры.
Большое количество делящихся клеток уже запрограммировано на самоуничтожение, – этот митохондриальный механизм называется апоптоз «по умолчанию». Выживают лишь 1-2% клеток, которые взамодействуют с молекулами ГКГ I и II классов, представляющими антигены собственного организма (все молекулы в тимусе свои!), которые выставлены на поверхности эпителиоцитов. Только если случайно образовавшиеся формы рецепторов дваждыпозитивных Т-лимфоцитов подходят к об- разам ГКГ, активационный сигнал дает импульс к выживанию и дальнейшему делению отобранного лимфоцита. Так происходит «обучение» иммуноцитов к распознаванию своего. У выживших выставляются рецепторы для продвижения из коры к кортико-медуллярной связке [26]. Там Т-лимфоциты CD4+CD8+ про- ходят отрицательный отбор, когда апоптозу подвергаются клетки с самым высоким сродством к МГКГ, нагруженных пептидами собственного организма, остаются лимфоциты среднего уровня аффинитета. А между тем собственные антигены тканей всего организма представляют эпителиальные клетки тимуса количеством около 19 000 белок-кодирующих генов, и даже при отрицатель- ном отборе всегда остается опасность аутоиммунных патологий, инициированных собственными Т-лимфоцитами [27]. Но против аутоагрессии существуют регуляторные механизмы, которые мы здесь разбирать не будем, потому что это слишком обширная тема.
Далее. Полагают, если тимоцит распознал (произошёл комплементарный контакт) пептид на МГКГ 1, он сохраняет рецепторы CD8 и утрачивает CD4, превращаясь в Т-киллеры CD8+; если распознал на МГКГ II, то сохраняет CD4 на поверхности и утрачивает CD8, превращаясь в Т-хелперы CD4+. То есть формируются однопозитивные Т-лимфоциты, которые продвигаются в мозговую зону, где 12 дней созревают, обретая множество рецепторов, определяющих их функции и адресность действий. В дальнейшем лимфоциты выходят из тимуса в общий кровоток, откуда попадают в лимфатические узлы для реализации Т-зависимого иммунного ответа [28]. Однако прежде чем описать их дальнейшую судьбу, разберём подробнее процесс образования миллионов вариантов рецепторов для антигенов.
Реаранжировка генов. Деление клеток, их размножение и увеличение популяции происходит по сигналу из ядра. Там, в хроматине со свернутой ДНК, происходят главные процессы копирования и синтеза структур клеток. Упорядоченные участки в хромосомах лимфоцитов между сегментами генов V и DJ удаляются в результате глубокой перестройки структуры генетических кластеров, кодирующих рецепторные гены. Перестройка называется реаранжировкой (рекомбинацией) генов.
Этот процесс происходит при дифференцировке в каждом лимфоците независимо, что приводит к формированию зрелого V-гена, уникального для данной клетки. Случайно отобранные V и DJ – сегменты соединяются, при этом неиспользуемый генетический материал удаляется. В некоторых местах происходит разрыв двух нитей ДНК, причём не в точно определенной позиции, а с возможными отклонениями в несколько нуклеотидных остатков. Разорванные нити ДНК замыкаются друг на друга. В результате формируется «шпилька», вырезанный отрезок замыкается при соединении двух нитей с формированием кольцевой структуры – рекомбинационного
вырезанного кольца REC (Recombination excision circle).
На следующем этапе происходит повторный разрыв ДНК, но не на вершине «шпильки», а сбоку. В составе ДНК появляется новая последовательность случайного состава. Запуск перестройки генов, кодирующих антигенраспознающие структуры BCR и TCR, происходит под влиянием дифференцировочных сигналов. Неудачи при реаранжировке генов чаще всего связаны со сдвигом рамки считывания, происходящим в 2/3 случаев. Тогда перестраивается ген на другой хромосоме аллельной пары. При неудачной перестройке генов иммуноглобулинов на обеих хромосомах клетка погибает апоптозом. Для подготовки к встрече с антигенами суммарная вариабельность антигенраспознающих участков должна достигать для BCR-рецепторов 100
квадриллионов, а для TCR – 10 квинтиллионов вариантов.
Однако количество лимфоидных клеток организма всего триллион, то есть в миллионы раз меньше, и формируются лишь 100 миллионов вариантов генов по всей популяции лимфоцитов [29].
О невозможности точно воспроизвести специфический иммунитет искусственным путем говорит научное открытие 2001 года – молекул микроРНК (microRNA, miRNA). Оказывается (из 23000 генов человека), как пишет Александр Сергеевич Спирин, только 2% геномной ДНК кодируют синтез белков (получается менее 500 белков – АА), в то же время 80% генома копируется в различные виды некодирующих РНК, функции которых пока неизвестны. Анализ «транскриптома», то есть репертуара РНК только начинается [30]. Напомним, что синтез белка происходит на основе длинной цепи РНК в сотни и тысячи последовательностей нуклеотидов. В то же время синтезирующий аппарат с рибосомами плавает в «густом бульоне» коротких микроРНК, каждая из которых содержит около 20 пар нуклеотидов, влияющих на 30-60% генов, с которых снимается информация преобразования в РНК и белковые последовательности. При этом микроРНК могут не только активировать некоторые виды синтеза, но и глушить, подавлять его. МикроРНК с белком аргонавт образуют RISC (RNA-induced silencing complex) индуцированный комплекс глушения. RISC «садятся» на мишень и разрезают эту мишень на участки [31], размер которых мало предсказуем.
Но если ещё вспомнить о малых интерферирующих РНК, меняющих метаболизм клеток, то возникают трудно доступные пониманию процессы с иммуногенезом и мутагенезом, на данный момент не поддающиеся стройному анализу. Свободные интерферирующие РНК и микроРНК без какой-либо защиты или модификации легко разрушаются нуклеазами. Хотя экспериментаторы и пытаются использовать несколько рекомбинантных вирусных векторов на основе ретровируса, аденоассоциированного вируса, аденовируса и лентивируса [32], но эта работа «вслепую» вряд ли приносит пользу.
Почему у исследователя возникают сомнения? Повторим главные стадии самого длинного процесса иммуногенеза от попадания вируса к человеку до клеток памяти. Новый вирус, воервых,
может представлять собой смесь после взаимодействия вирусов, принимающих участие в смешанной инфекции. То есть на поверхность клетки макроорганизма может адсорбироваться два и более вирусов. Между ними происходит обмен генетическим материалом и возникают геномы, содержащие гены обоих вирусов-родителей. Есть механизм, способный осуществить истинную рекомбинацию между разными вариантами вируса гриппа. Хотя скрещивание чаще происходит среди подобных вирусов (герпеса, гриппа и др.), обнаружили образование рекомбинантов между различными, например, аденовирусом и вирусом SV-40, т.е. двумя неродственными вирусами. Рекомбинация возможна между вирусом человека и обезьян. Во-вторых, новый сложный вирус, представляет собой не только самого себя, но и на внешней оболочке комплекс из собственных белков и чужих фрагментов клеточных мембран предыдущего хозяина, макроорганизма, который реплицировал своё детище, как результат случайного захвата его клеточного материала при сборке вирионов. Он представляет собой смесь рецепторов, иммунологических маркёров, белков МГКГ, рибосомных белков, компонентов цитоскелета клетки и др. Кстати, в ряде случаев такое включение клеточных компонентов является необходимым условием поддержания инфекционности вирусов.
Фиксация происходит, если имеется соответствие рецепторных белков вируса клеточным поверхностным рецепторам, которые выполняют какие-либо физиологические сигнальные функции. Прикрепление к ним вируса может повредить или активировать соответствующие биохимические пути и изменять метаболизм клеток. Например, гепариновые протеогликаны инициируют прикрепление альфагерпесвирусов к клетке (оказывается, не только коронавирусы могут влиять на свертываемость крови – АА). После контакта дополнительные молекулы, корецепторы, меняют конформацию белков клетки из неактивной в активную, и запускается процесс входа вируса в клетку. Изолированные участки двухслойных липидных мембран инвагинируют и секвестрируют в клеточной цитоплазме макромолекулярные структуры вирусов с
сопутствующим «балластом», включая собственные компоненты клетки, образуя аутофагосомы. Аутофагосомы затем «причаливают» к лизосомам, внешняя мембрана которых сливается с аутофагосомой, а внутренний листок мембраны оказывается внутри лизосом в компартаменте деградации. Эта стадия биогенеза везикулы получила название аутофаголизосомы.
В аутофаголизосомах инвагинированные структуры расщепляются под действием лизосомальных гидролаз до нуклеотидов, аминокислот, жирных кислот, которые затем включаются в новый синтез клеточных макромолекул и генерацию АТФ, и тем самым восполняют внутриклеточный пул метаболических резервов жизнедеятельности. Аутофагосомы могут участвовать в деградации чужеродных антигенов и их презентации МГКГ для иммунного ответа.
Хотя, как говорилось выше, образование эпитопов для МГКГ может идти также и по протеосомальному пути. Некоторые вирусы вообще уничтожаются аутофагией, другие выживают, например герпеса, гепатита С [33]. Аутофагия чужеродного материала называется ксенофагией и в экспериментах после включения вирусных антигенов приводит к усилению представления антигена в системе МГКГ II в 20 раз [34].
Рахим Мусаевич Хаитов подтверждает случайность подбора комплементарных молекул. В Т-зависимых зонах лимфатических узлов дендритные клетки представляют антигены в комплексе с
МГКГ II интенсивно рециркулирующим Т- лимфоцитам, как бы проверяя их возможность к комплементарному контакту. Среди Т-клеток рано или поздно встретится лимфоцит, несущий рецептор с щелью-паратопом, подобной данному антигену с выступом-эпитопом. Если состоятся все необходимые и достаточные корецепторные взаимодействия с ДК, тогда Т-лимфоцит начнет
делиться, в результате образуется клон Т-лимфоцитов с одним и тем же рецептором по строению. Корецепторы CD4 и CD8 находятся на мембране рядом с TCR хелпера или киллера соответственно, они фиксируют МГКГ II и МГКГ I соответственно, в то время как TCR входит в контакт с эпитопом. Это обеспечивает двойное распознавание антигена [35].
Если такой случайной встречи не произойдет, лимфоциты будут рециркулировать далее из лимфоузла в общий грудной лимфатический проток, потом в кровоток, затем в селезенку и в костномозговое вещество, затем снова в кровь и снова в лимфоузлы или тимус, пока очередной какой либо иной эпитоп-пептид, представленный на молекуле ГКГ антигенпредставляющей клеткой, не подойдет по строению. Иначе лимфоцит погибнет апоптозом. Большинство зрелых «наивных» лимфоцитов поступает из органов в циркуляцию и обратно 1-2 раза в день. [36].
Теперь рассмотрим подробнее, что такое активационный сигнал, дающий жизнь иммуноциту. Понятие «комплементарный» означает пространственно взаимодополняющий, облегчающий образование связей между молекулами и их структурными фрагментами. Итак, встреча подобного с подобным состоялась. Когда происходит комплементарный контакт, то есть эпитоп плотно (высокоаффинно) входит в принимающую щель паратопа иммуноглобулина, меняется конформация его стереохимических структур, начинает совершаться необратимый процесс кластеризации – активируется иммуноглобулиновый рецептор, выстраиваются в порядок все последующие звенья комплекса, благодаря передаче через белки-посредники [37].

Переходя в активную конформацию, рецептор активирует G-белок с внутренней стороны мембраны, который гидролизует (отсоединяет) фосфорный остаток от гуанозинтрифосфорной
кислоты (ГТФ), являющейся таким же макроэргом как АТФ, а фосфорилирование белков дает энергию и переводит их в активную форму. Так передается энергетический импульс, который заводит внутри клетки биохимические механизмы для реализации иммунных реакций с последующим размножением путем деления. Описаны разные пути передачи энергии, например: G-белок активирует аденилатциклазу, которая синтезирует цАМФ, которая в свою очередь активирует протеинкиназы, переносящие остаток фосфата с АТФ на различные группы в структуре белка и идет активный синтез необходимых веществ внутри клетки [38].
После того, как неиммунный лимфоцит был «отомкнут» подходящим антигеном-лигандом, он перестает путешествовать по организму. Объемы его ядра и цитоплазмы увеличиваются, синтезируются новые мРНК и новые белки. В течение нескольких часов вид лимфоцита меняется, его уже называют лимфобластом. Численность делящихся лимфобластов увеличивается в 2-4 раза каждые 24 часа в течение 3-5 суток. Образовавшиеся примерно 1000 дочерних клеток В или Т-лимфоцитов являют собой клоны с одним и тем же рецептором. На поверхности В-лимфоцитов формируются рецепторы BCR, на поверхности Т-лимфоцитов –рецепторы TCR, причём и те и другие представляют собой антитела=иммуноглобулины, встроенные одним концом в липидный бислой мембраны клеток. Разница состоит в том, что антитела IgM рецепторов BCR отсоединяются от мембраны, сползают с поверхности и выходят в растворимом состоянии в кровь или тканевую жидкость, ставят черную метку на патогенах для дальнейшего уничтожения системой комплемента
или фагоцитами. А рецепторы=антитела Т-лимфоцитов TCR прочно встроены в клеточную мембрану, не отсоединяются от клетки и передвигаются только с нею. Кроме того, BCR рецепторы такие же по строению как антитела с двумя антигенсвязывающими центрами, а TCR-антитела имеют один антигенсвязывающий центр.
Число TCR достигает 30 000 одинаковых рецепторов на одном и том же Т-лимфоците [39], в то же время количество BCR на В-лимфоците доходит до 200 000 рецепторов [40].
7.2.2.2. Подробнее о В-клеточном ответе
Обратимся к упорядочению понимания В-лимфоцитарного сегмента иммунных реакций. Для этого придётся опять начинать описание процесса иммуногенеза сначала. Антигены микроорганизмов и вирусов транспортируются в лимфатические узлы по приносящим лимфатическим сосудам и в селезенку с кровотоком. Помеченные белками системы комплемента С3 цельные антигены накапливаются в В-клеточных фолликулах, сцепленные с рецепторами CR на поверхности фолликулярных дендритных клеток (follicular dendritic cell, FDC) или макрофагов. FDC и макрофаги этой зоны ведут себя необычно – они удерживают антиген на поверхности годами, не фагоцитируют и не разрушают его. Тем самым цельный антиген стимулирует иммуногенез долгое
время. А В-лимфоциты могут переносить его в различные зоны для иммунных реакций [41]. В-клеток существует несколько типов и есть два пути синтеза антител, весьма различающихся по
результату. В1-лимфоциты преимущественно реагируют сразу, в первые минуты контакта с патогеном и секретируют антитела всю первую неделю, этот врожденный иммунный ответ называют Т-независимым. В отличие от него В2-лимфоциты проходят полный цикл Т-зависимого ответа сначала как как антигенпредставляющие клетки (АПК) и затем как антителопродуценты – плазматические и клетки памяти [42].
При первичном иммунном ответе В-клетками сначала секретируются IgM антитела, пик концентрации антител в сыворотке крови достигается на 5-6 сутки, затем секретируются IgG антитела, пик на 10-12 сутки. Что любопытно, В-лимфоциты «отмыкаются» для производства ранних антител цельными антигенами при контакте с ними в первые же сутки, в то время как одновременно В-лимфоциты в качестве АПК заглатывают и переваривают эти патогены, разрезая белковые цепи на кусочки пептидов и через несколько дней представляют их Т-лимфоцитам. Последние формируют клоны двух видов. Т-киллеры CD8+ уничтожают те же самые патогены, Т-хелперы как помощники CD4+ стимулируют В-лимфоциты к дальнейшей выработке антител IgA, IgG, IgE после 10-го дня иммунного процесса [43]. Только сначала IgM, как антитела первого эшелона обороны, переходя с заякоренного состояния мономера в окружающую жидкость, в растворимом состоянии становятся пентамерами. Для пентамеров IgM высокая точность связывания с антигеном не обязательна, так как областей связывания в них в пять раз больше, а для мономеров IgG второго эшелона обороны необходима.
Для синтеза антител В1-лимфоцит преобразуется в плазматическую клетку, этот процесс происходит достаточно быстро – в течение первых суток после стимула [44]. Считают, что В1-лимфоциты, преимущественно расположенные в плевральной и брюшной полостях, не только постоянно продуцируют естественные антитела, но сразу реагируют на появление нового патогена. По-видимому, эта быстрая готовность к защите связана с густой населённостью желудочно-кишечного тракта и дыхательной системы представителями сапрофитной, условно-патогенной и патогенной флоры и постоянным появлением новых антигенов.
Человек вдыхает воздух каждые две секунды и принимает пищу по крайней мере три раза в день. При этом В1-лимфоциты производят не только IgM, но и IgA, IgG нативные иммуноглобулины, они не оставляют клеток памяти [45]. В то же время В2-лимфоциты, составляющие в крови 95%, участвуют в полноценном длинном пути иммуногенеза, включающем контакты с Т-лимфоцитами, с конечным образованием клеток памяти. Хотя существует не только В-Т взаимодействие, но и В-В взаимодействие. Как будто бы В1-клетки считают главными регуляторами микробиоты, однако всё в организме взаимосвязано, и при нарушении нормобиоты падает концентрация В2-лимфоцитов [46].
Чем же определяются два пути преобразования В-лимфоцитов из одного предшественника? Буквально, путями их движения внутри лимфатического узла. Одни при фильтрации лимфы в лимфатическом узле движутся в мякотные (мозговые) шнуры, оседают там, превращаются в плазматические клетки в течение недели производят антитела IgM [47].Дру
гая часть В-лимфоцитов под влиянием молекул хемокинов, движутся в первичные фолликулы у корковой зоны лимфоузла. Находящиеся там в покое первичные узелки преобразуются во вторичные узелки, они же активные центры размножения, или зародышевые центры, они же герминативные центры. Активность в них в результате поступления каждого нового антигена продолжается от нескольких дней до 3-4 недель [48].
Гистологически зародышевый центр растёт по мере развития иммунного ответа, а затем сжимается и, наконец, исчезает, когда инфекция выводится из организма. Лимфоидный узелок возвращается в стадию покоя, при этом остаются малые лимфоциты в виде В-клеток памяти в месте инволюционировавших вторичных узелков, называемом «корона» [49].
В-лимфоциты связывают своими рецепторами BCR естественные конформационные эпитопы всей белковой молекулы, состоящей из сотен аминокислотных остатков и могут синтезировать на них антитела. Но в то же время В-клетки фагоцитируют как АПК эти длинноцепочечные молекулы антигенов, разрезают их на короткоцепочечные пептиды по 8-15 аминокислотных остатков и представляют эти (уже) линейные эпитопы на поверхности в щелях Бьоркмана МГКГ для Т-лимфоцитов [50]. Один и тот же вирус даёт несколько антигенов – одни антигенные компоненты связаны с его оболочкой, другие представляют собой частицы нуклеокапсида внутреннего содержимого (генома) [51]. Например, вирус гепатита В состоит из оболочки (HBsAg) и нуклеокапсида HBcAg). Однако ответ на них разный.
Иммунодоминантный пептид – один из нескольких иммуногенных пептидов, выделенных из антигена, на который развивается наиболее интенсивный иммунный ответ [52].
Исходя из динамики синтеза антител проблемы в чудесных планах вакцинации с точки зрения иммунодоминантности две. Во-первых, коротких представителей-эпитопов несколько и какой из них окажется иммунодоминантным, то есть вызывающим иммунный ответ, у каждого конкретного человека, непредсказуем. Разные варианты иммунного ответа объясняют случаи, когда на одну и ту же вакцину, например, АКДС, один ребенок ответит эпилепсией, другой тромбоцитопенической
пурпурой, третий системной красной волчанкой, четвертый поствакцинальным гломерулонефритом, а большинство детей не ответит никак. Во-вторых, стереохимический образ
конформационных эпитопов вакцин, измененный химическим веществом для ослабления живого возбудителя (например, формалином), либо рекомбинантные варианты, не соответствуют образу эпитопа естественных возбудителей. Иммунизация этой вакциной не приводит к формированию нейтрализующих антител у здоровых добровольцев [53].
Однако вернёмся к естественным антигенам при обычной ОРВИ. В зародышевых центрах лимфоузлов, в участках интенсивного деления и смерти клеток, плотно собраны фолликулярные дендритные клетки FDC, В-лимфоциты, Т-лимфоциты, макрофаги и большое количество 7 α,25 гидроксихолестерина, обязательного участника межклеточного рецепторного и синаптического взаимодействия. Именно молекулы холестерина являются лигандами хемокиновых рецепторов, обеспечивающих продвижение лимфоцитов в тёмные зоны [54].
В-лимфоциты, попавшие в зародышевый центр, уже называют В-центробластами, они начинают делиться в огромных количествах, и одновременно в ядрах активируется ген фермента АИД (Activation-induced citidine deaminase). Чем-то эта аббревиатура напоминает древнегреческого бога подземного царства смерти АИД. И действительно, синтезированный фермент АИД, словно оправдывая свое наименование, разрушает ДНК, что приводит к большому количеству мутаций В-центробластов (гипермутагенез). Большинство мутантов пожираются макрофагами, потому что они не способны выставлять на поверхность рецепторы BCR необходимой конфигурации. Вследствие содержания в цитоплазме макрофагов большого количества ядерного вещества эта зона гибели окрашивается в тёмный цвет. А мы должны помнить, что лимфоциты выживают именно благодаря комплементарному контакту с антигеном, который меняет конформацию рецептора и инициирует энергетический каскад белков-мессенджеров, передающих активационный сигнал внутрь клетки. Таким образом, меньшинство выживших центробластов оказываются с полезной мутацией гена рецептора, подходящего по строению к антигену. Поскольку только такие клетки выживают, с каждым делением их всё больше, и всё больше «притирается» эпитоп к паратопу, то есть созревает аффинитет, сродство рецептора к антигену. Затем они прекращают делиться, переходят в светлую зону фолликулов, становятся В-центроцитами.
В светлой зоне фолликула для отбора В-клеток фолликулярные дендритные клетки выставляют на поверхности Fcγ-рецеп торы, которые связывают иммунные комплексы. Кстати, в таком виде чужеродные антигены способны сохраняться долгое время в зародышевых центрах уже после их периода высочайшей активности воспроизводства клеток. Комплементарный контакт нового варианта BCR увеличивает выживаемость В-клетки в 100 раз, предохраняя её от апоптоза [55].
На фолликулярных ДК выставлены рецепторы для комплемента CR, на которых также фиксируются антигены, поступившие с лимфой и связавшиеся с белками системы комплемента. Они представляют антиген В-лимфоцитам для стимуляции синтеза антител. Фолликулярные ДК не фагоцитируют антигены, не перерабатывают их в короткоцепочечные пептиды и не двигаются из фолликула лимфатического узла. В отличие от них интердигитирующие ДК прибывают с током лимфы из покровного эпителия, в процессе движения перерабатывают поглощённые антигены в короткоцепочечные эпитопы, оседают в Т-зоне стромы лимфоузлов и представляют эпитоп Т-лимфоцитам. Там они переплетаются (от англ. interdigitating – переплетающиеся, чередующиеся) свои ми отростками, образуя сеть для более плотного соприкосновения с Т-клетками [56]. Интересно, что центроциты возвращаются в темную зону, становясь снова центробластами. Осуществляется циклическое повторное вхождение, благодаря которому ещё более созревает аффинитет. Когда зародышевый центр становится максимального размера, там отобраны уже один или несколько клонов В-лимфоцитов к разным антигенам одного и того же патогена [57].
Гипермутагенез коренным образом отличается от реаранжировки генов лимфоцитов, которая даёт как можно большее количество вариантов конфигураций рецепторов для случайной встречи с любыми патогенами ещё до этой встречи, в пределах вилочковой железы. Гипермутагенез происходит уже после контакта, и активированный В-лимфоцит его претерпевает в зародышевой
зоне лимфоузла под влиянием микроокружения: ДК, Т-лимфоцитов, макрофагов, синтезирующих цитокины. Кроме того, гипермутагенез с помощью фермента АИД происходит только в В-лимфоцитах.
7.2.2.3. Взаимодействие ДК, В- и Т-лимфоцитов
Общая картина приобретенного первичного иммунного ответа, первого в жизни макроорганизма контакта с патогеном, выглядит следующим образом. Захватив чужеродные элементы, ДК из барьерных тканей попадают в региональный лимфоузел, где превращаются в интердигитирующие, с плотно сплетенными отростками. Каждая ДК фагоцитирует и выставляет на поверхность более тысячи видов эпитопов разных патогенов на МГКГ II,которых около 30 000. В течение часа одна ДК контактирует с 500-5000 Т-лимфоцитами, прибывшими в Т-зону лимфоузла с током крови. Если рецептор TCR не подошёл по конфигурации, через 10 минут Т-клетки опять уходят в рециркуляцию. Если же конфигурации случайно совпали, тогда между ДК и Т-лимфоцитом образуется иммунный синапс для передачи сигнала. Обе клетки поляризуются, происходит перестройка цитоскелета, нити
актина направляются к месту контакта, клеточный центр организует микрорубочки, перемещаются внутриклеточные белки с помощью моторных белков динеинов. Происходит сближение клеток между собой на 5-15 нм и кластеризация, выстраивание в порядок трансмембранных и цитоплазматических белков. Вспомним, что клеточная мембрана не является плотной. Она представляет собой скорее вязкий гель, на поверхности которого к месту контакта подходят холестериновые рафты-плоты с встроенными в них белками-передатчиками сигналов и молекулами CD4 и CD8, а также костимулирующими молекулами. В ДК в состав рафтов входят МГКГ II и костимилирующие молекулы. В покоящихся клетках рецептор TCR с холестериновым рафтом не связан, но при формировании нековалентной связи между TCR и CD4, молекула CD4 как бы втягивает рецептор в рафт, кластеризуются другие молекулы, и через 10-20 минут их плотность достигает максимума. Мембрана лимфоцита заворачивается внутрь, рецептор МГКГ интернализуется [58].
Процесс откусывания участка контактной клетки называется трогоцитозом, в отличие от полного поглощения клетки клеткой, называемого фагоцитозом. Иммунная клетка может принять кусочек отгрызенной мембраны за свою собственную, что позволяет ей выводить новые белки на свою поверхность для активации иммунных реакций. Когда клетка представляет белки, которые приобретены подобным образом, это называется перекрестным переодеванием. В этом заключается механизм обмена информацией путём торгоцитоза [59].

Важнейшим моментом передачи информации является то, что после взаимодействия TCR и комплекса МГКГ-пептид происходит фосфорилирование с активацией внутренних белков, этот рецептор TCR также интернализируется и поглощается клеткой. Взамен поступает другая молекула TCR и все события повторяются. Так один комплекс МГКГ-пептид дендритной клетки может взаимодействовать с 200 комплементарными молекулами TCR лимфоцита за 1 час. И если Т-хелпер CD4+ получает пептид от ДК представленный МГКГ II, то Т-киллер CD8+ получает антигенный пептид (эпитоп) от ДК представленный МГКГ I и получает корецепторный сигнал через молекулу CD8. Подобным образом через такой же иммунный синапс Т-клеткам представляют эпитопы макрофаги и В-лимфоциты [60].
В плотно населенной зародышевой зоне лимфоузла В-лимфоциты получают первый сигнал от цельного антигена, например, вируса, который захвачен и покоится на поверхности фолликулярной ДК, сцепленный либо с антительными рецепторами FcγR, либо рецепторами комплемента CR (молекулами с кластером дифференцировки CD21). Затем они получают второй сигнал
от фолликулярного Т-хелпера TFH CD4+. Изначально было обнаружено in vitro, что оставшиеся В-лимфоциты могут выжить, только если они почти одновременно подвергаются двум процессам: сшиванию BCR антигеном, который находится на поверхности фоликулярной ДК и контактом с поверхностной молекулой CD40L фолликулярного Т-хелпера. При этом в течение суток от первого сигнала должно обязательно произойти взаимодействие В- и Т-лимфоцитов. С одной стороны, В-клетка перерабатывает как АПК антиген на короткие пептиды, представляет их Т-клетке, у которой на поверхность в результате выставляется молекула –лиганд CD40L (ligand), которая должна войти в контакт в рецептором CD40 на поверхности В-лимфоцита. Если в течение суток этого не произойдет, В-клетка погибнет апоптозом. Обмен через синапс взаимный. Активированный комплементарным контактом фолликулярный Т-хелпер выделяет цитокины, которые переключают IgM и IgD у В-лимфоцита на синтез IgA, IgE, IgG. Процесс переключения происходит при участии вышеупомянутого фермента АИД. Затем, под влиянием цитокинов, одни В-клетки превращаются в плазматические, другие в клетки памяти, которые расселяются в костный мозг, селезенку и собственную пластинку слизистой, где реализуют свои эффекты.
Дендритные клетки, которые принесли антиген из участка воспаления, индуцируют в лимфоцитах хоуминговые рецепторы, так они понуждают лимфоциты двигаться обратно в ткани туда, откуда пришли, то есть домой (от англ. home – дом). Там лимфоциты этими рецепторами входят в контакт с адрессинами и оказываются в случае, например, ОРВИ в собственной пластинке слизистых по необходимому адресу. В основе способности действующих лимфоцитов и клеток памяти «находить» отдел слизистых оболочек, в котором произошёл захват антигена дендритными клетками, лежит механизм импринтинга, запечатления. Все разновидности эффекторных Т-клеток, сформировавшихся в региональном лимфатическом узле, покидают его с эфферентной лимфой и в составе лимфы грудного протока поступают в общий кровоток. Дальнейшее распределение Т-клеток определяется выставленными на поверхность мембраны рецепторами. Эти клетки способны
мигрировать предпочтительно в лимфоидные ткани, ассоциированные со слизистыми оболочками, преимущественно в отделы, из которых происходят индуцировавшие их дендритные клетки». Интегрины взаимодействуют с кадгеринами, что способствует удержанию мигрировавших Т-клеток в эпителии. Важную роль в привлечении Т-клеток в эпителий слизистых оболочек, включая регион дыхательных путей, играет хемокин CCL5 (RANTES), спонтанно вырабатываемый стромальными клетками лёгких, распознаваемый рецептором CCR5 лимфоцитов. Другая пара молекул (хемокин и его рецептор), которая участвует в привлечении действующих Т-лимфоцитов и клеток памяти в слизистые оболочки, CCL28 (MEC) и CCR10. В-клетки памяти также двигаются в слизистые благодаря этим рецепторам и хемокинам и выделяют там IgA. Миграция лимфоцитов в слизистые оболочки усиливается при воспалении, когда увеличивается синтез хемокинов, селектинов и интегринов [61].
При ОРВИ с кишечным синдромом лимфоциты направляются в слизистую кишечника. Например, для клеток венул кишечника адгезинами являются MAdCAAM-1, а для лимфоцитов – интегринами α4β7. Антигены, введенные парентерально, поступают в региональные лимфатические узлы, в которые идет сброс лимфы от места введения вакцины. По поводу гриппа прививки делают в мышцу бедра или плеча, по поводу коронавируса в дельтовидную мышцу плеча и т.д. Там происходит процессинг и презентация антигенов лимфоцитам [62]. Вакцину по поводу вируса папилломы человека вводят в дельтовидную мышцу [63]. Отсюда возникают неразрешимые для современной вакцинологии вопросы.
Вакцинаторы считают, что место введения антигена не имеет значения. Однако феномен хоуминг-эффекта исключает эффективность многих типов вакцинаций, потому что вакцина, введённая по поводу респираторной, энтеральной или генитальной инфекции внутримышечно, никак не вызовет продвижение иммунных лимфоцитов в слизистую дыхательной системы, кишечника или гениталий, так как не имеет ни хемокинов, ни молекул адгезии, ни молекул экстравазации к месту поступления природного патогена.
Из-за рассогласования экспрессии хемокиновых рецепторов на Т-клетках и хемокинов опухолей такая же проблема обнаруживается в онкологии. Например, это признается в разработке инновационных терапевтических стратегий, основанных на генетически модифицированных Т-клетках, экспрессирующих химерный антигенный рецептор (CAR). Обсуждаются задачи ликвидации
препятствий к попаданию препарата по адресу назначения – опухоли [64].
Вернемся к специфическому иммунитету. Цитотоксические лимфоциты Т-киллеры CD8+ уничтожают пораженные вирусом и опухолевые клетки организма таким же перфоринранзимовым
механизмом, как и натуральные киллеры, индуцируя в них апоп тоз. Реализация цитотоксическогй активности нами подробно описана в главе 6. Избирательность состоит в отборе рецепторного аппарата. В Т-клеточной зоне лимфоузлов АПК представляют эпитопы на молекуле ГКГ I лимфоцитам, среди циркулирующих находится клетка с комплементарным рецептором TCR, начинает образовываться контакт. К месту кластеризации в обеих контактирующих клетках подходят холестериновые рафты-плоты с рецепторами, лигандами и прочими молекулами. Липидные рафты сливаются вместе и образуют иммунный синапс. Учитывая, что АПК представляет сразу несколько разных эпитопов патогена, в результате активационных сигналов лимфоциты начинают делиться, образуя несколько клонов по форме нескольких (разных) эпитопов представленных АПК [65]. Цитотоксические Т-лимфоциты продвигаются к местам воспаления или поврежденным опухолями тканям, привлекаемые хемокинами, на сегодня обнаружено 50 низкомолекулярных единиц этого семейства цитокинов [66]. Созревание Т-клеток CD8+ заключается в том, что каждым делением в них усиливается потенциал сигнала к повреждению мишеней, накапливаются гранулы с перфоринами и гранзимами, одновременно каждое последующее поколение имеет меньший потенциал к делению. Поэтому первые митозы протекают без агрессии, и только после образования большого пула Т-киллеров они начинают ликвидацию распознаваемых вирусных или опухолевых патогенов. А патологически измененные клетки
макроорганизма всегда имеют на своей поверхности МГКГ I, которые выставляются в силу постоянно протекающих процессов аутофагии собственных элементов любой клеткой [67].
Какой из клонов эффективней, какие клоны соперничают между собой, возможно, иногда подавляя другу друга, либо вообще случайно совпали с некоторыми сигнальными молекулами макроорганизма – итоги Т-иммунных реакций могут оказаться непредсказуемыми. Результаты оцениваются начиная со второй недели иммунного ответа, при этом могут длиться месяцы и даже годы.
Подытоживая вышесказанное в плане противовирусной защиты, мы видим, что цитотоксические Т-лимфоциты (киллеры) CD8+ распознают зараженные вирусом клетки хозяина и уничтожают их. Т-клетки (хелперы) CD4+ секретируют цитокины, активирующие макрофаги, эозинофилы, базофилы и тучные клетки, побуждая их удалять патогены. Они также подавляют избыточные реакции с целью недопущения аутоиммунной патологии. Кроме того, Т-хелперы стимулируют В-клетки к переключению антител с IgM на секреторные антитела sIgA и IgG, хотя, как выяснилось, эти антитела в фоновом режиме естественного антителообразования уже предсуществовали ранее. В дальнейшем В-лимфоциты, Т-киллеры и Т-хелперы преобразуются в клетки памяти.
7.2.3. Третий эшелон обороны. Клеточная память («засада»)
Владимир Тимофеевич Пальчун указывает, что с помощью механизмов иммунологической памяти миндалины уже с первых дней жизни снабжают организм информацией об антигенной структуре окружающего мира. В частности, в криптах миндалин созданы условия для постоянного контакта иммунокомпетентных клеток с находящимися в лакунах антигенами [68]. Но не только на миндалинах – на всех слизистых находится биопленка,которая содержит тысячи видов микроорганизмов. Надежда Венедиктовна Шабашова дополняет: «Формирование и поддержка иммунологической памяти на наборы антигенов нормобиоты (образы-паттерны), аналогичные патогенным микроорганизмам, позволяет организму быстро и эффективно реагировать на повторные поступления многих патогенов» [69]. Здесь нелишне напомнить, что в состав нормобиоты человека входят пневмококки, стафилококки, столбнячные палочки, стрептококки, уреоплазмы, хеликобактеры и прочие представители условно-патогенной флоры [70].
Виталий Васильевич Зверев с соавторами уточнял: «Существует два механизма формирования иммунологической памяти. Один из них предполагает длительное сохранение антигена в организме, что поддерживает в напряжении иммунную систему. Этому имеется множество примеров: инкапсулированный возбудитель туберкулеза, персистирующие вирусы кори, полиомиелита, ветряной оспы и некоторые другие патогены. Вероятно также наличие долгоживущих дендритных АПК, способных длительно сохранять и презентировать антиген. [71].
На сегодня уже показано, что эти фолликулярные ДК, также как и макрофаги лимфоузлов, после фильтрации лимфы годами удерживают на своей поверхности естественные антигены и не фагоцитируют их. Они представляют собой сцепленные с Fc-рецепторами для антител или CR-рецепторами для белков системы комплемента бусиноподобные цитоплазматические тельца иккосомы, хранилища для антигенов. В-клетки могут переносить их и представлять другим эффекторным клеткам [72].
возрастом по мере ежегодной встречи с различными микробами, грибками, простейшими и новыми штаммами вирусов формируется иммунологическая память, и к пожилому возрасту из всего пула Т-лимфоцитов уже до половины составляют клетки памяти. Если первичный Т-иммунный ответ развивается в конце первой недели, достигая пика на 8-10 день, то вторичный Т-зависимый ответ при повторном внедрении начинается уже после второго дня, достигая пика на 5-й день» [73]. Следует обратить внимание, что это всё равно не быстрее механизмов врожденного иммунитета, развивающегося мгновенно [74].
При повторном внедрении патогена адекватный ответ клеток памяти развивается благодаря «хоуминг-эффекту» в тех тканях слизистой, где впервые произошёл контакт хотя бы и много лет
назад с подобным возбудителем [75]. Что касается искусственных моделей, то иммунологическая память в ответ на вакцинацию изучена недостаточно [76].
Иммуную память образно можно назвать «засада» для тысяч штаммов вирусов и микробов, циркулирующих в организме на протяжении всей жизни индивида. Она представляет собой клетки памяти В-лимфоциты, Т-киллеры и Т-хелперы, базирующиеся в барьерных тканях и костном мозге. Но есть ещё долгоживущие плазматические клетки, которые более 35 лет непрерывно синтезируют антитела, обеспечивая постоянную защиту макроорганизма [77]. И это не предел – описана продолжительность жизни плазматической клетки, секретирующей антивирусные антитела 75 лет [78].
Если подводить окончательный итог описанию клеточного сегмента индивидуальной неприкосновенности тканевых структур тела человека, то главные элементы пожизненного эшелона обороны, иммунитета, это клетки памяти, долгоживущие плазматические клетки, иккосомы и микробиота.
Общая картина клеточного иммунного ответа, представленная нами сегодня, гораздо сложнее. Например, В-лимфоциты в мякотных шнурах, те самые, быстро синтезирующие IgM, преобразуются не только в короткоживущие плазматические клетки, но и не зависящие от зародышевого центра (GC-independent) В-клетки памяти, чаще с непереключённым изотипом иммуноглобулинов (unswiched B-memory cell, unswBm) [79]. Точно также и другие клетки многократно дублируют защитные реакции описанных выше элементов иммунного ответа – MZB, NKT, γδТ-клетки и прочие. Антигенпредставляющими клетками, кроме классических ДК, макрофагов и В-лимфоцитов,
могут быть многие представители – эпителиальные, эндотелиальные [80]. Синусоидальные эндотелиальные клетки и гепатоциты, экспрессируя молекулы главного комплекса гистосовместимости (HLA) II класса, обладают способностью локально в печени представлять антигены Т-клеткам. В результате такого взаимодействия Т-клетки образуют популяции функциональных T-эффекторных лимфоцитов [81].
Иммунологическая память присутствует в человеческом организме всю его жизнь, и время от времени клетки памяти активируются в ответ повторные встречи с теми или иными патогенами или условно-патогенными вирусами. То же самое происходит и с иммунным ответом на вакцинацию. Мировая сенсация произошла, когда был открыт феномен первичного антигенного греха, или антигенный импринтинг (запечатление). Впервые он был описан в 1953 году Davenport et al., которые обнаружили низкие титры антител после вакцинации в ответ на гриппозную вакцину, но высокие титры антител обнаружены на штаммы вируса гриппа, который больные перенесли за несколько десятилетий ранее. Позже Davenport и Hennessy при проведении экспериментальной вакцинации обнаружили иммунный ответ не на вацинный штамм, а на сероподтипы вируса, которым испытуемые болели за 10-20 лет ранее. Было окончательно установлено, что люди более ярко реагируют не на вакцинные штаммы, а на перенесенные в раннем детстве виды вирусов, либо прежние варианты взрослого периода индивида. Например, при вакцинации штаммом Шотландия/74 у большинства появились антитела на грипп Гонконг/68, с которым люди контактировали ранее. Учитывая иммунный ответ на ложные цели, в результате вакцинации больные оказываются в незащищенными от актуального штамма вируса текущего эпидемического сезона, они болеют тяжелее и смертность у них выше. Исследователи делают вывод, что иммунный ответ на вакцинацию малопредсказуем. Но что самое главное, – поствакцинальные осложнения, связанные с антигенным импринтингом, могут проявляться через десятилетия после ее проведения [82]. Введение чужеродных белков, даже короткоцепочечных пептидов, то есть новых элементов конформационной матрицы, может приводить к конформационным болезням. Появляются болезнь Альцгеймера, Паркинсона, прионные болезни [83], катаракта, пигментный ретинит сетчатки глаза [84], боковой амиотрофический склероз и прочие неизлечимые болезни [85]. Отсроченный на годы негативный эффект затрудняет оценить реальную пользу или вред вследствие вакцинации.
Учитывая факт сложности взаимовлияния миллиардов иммунноцитов и триллионов рецепторов, в XXI веке требуется, очевидно, новый подход в восстановлении нормальной защиты человеческого организма при патологии.
7.3. Причины нарушения клеточного иммунитета
Саногенетический подход к иммунным процессам означает не мешать организму реализовывать их защитные функции. Нередко подавление иммунного ответа вызывают фармакологические средства. Чаще всего это нарушение работы эпителиальных клеток путем высушивания слизистой дыхательных путей вследствие применения:
1) адреностимуляторов (сосудосуживающих капель в нос);
2) Н1-гистаминоблокаторов (антиаллергических препаратов);
3) Н2 гистаминоблокаторов (противоязвенных препаратов);
4) β-адреноблокаторов;
5) ингибиторов протонной помпы.
Происходит уменьшение секреции эпителиальными клетками дефензинов, лактоферрина, лизоцима, интерферонов, секреторных антител sIgA и sIgM и множества других защитных белков слизистой. Потеря мукозальной защиты нами подробно описана в главе 2.
Падение числа нейтрофилов ниже 2,5 миллиардов клеток на литр крови означает нейтропению. Её могут вызывать НПВС, гипотензивные препараты, антибиотики, диуретики, сахароснижающие препараты, аллопуринол и многие другие средства, подробнее в главе 5. Целесообразно напомнить, что развитие лекарственно-ассоциированной нейтропении в большинстве случаев непредсказуемо, данная реакция может дебютировать через 7–40 дней после отмены препарата. [86]. Такое отсроченное действие позволяет предположить, что разрушительный эффект ксенобиотиков связан не столько с токсико-биохимическими, но более с иммунными механизмами.
В справочнике по иммунологии Оксфордского университета доктор Гевин Спикетт указывает на подавление различных звеньев клеточного иммунитета вследствие излишнего применения фармакотерапии. Терапия противосудорожными средствами, особенно фенитоином и карбамазепином, ассоциирована с гуморальным иммунодефицитом. И не факт, что прекращение приёма этих препаратов приведёт к устранению подобных нарушений. Глюкокортикостероиды могут вызвать: снижение фагоцитоза и высвобождения ферментов (стабилизацию лизосом); выраженную моноцитопению и снижение концентрации интерлейкина 1; лимфопению вследствие нарушения рециркуляции, а также вследствие лимфотоксического действия; снижение пролиферативного ответа Т-клеток (ингибируют вступление в фазу G1); снижение сывороточных концентраций IgG и IgA. Противомалярийные препараты гидроксихлорохин, мепакрин уменьшают продукцию цитокинов и выработку лизосомальных ферментов гранулоцитами. Эти лекарственные препараты накапливаются в лизосомах, вызывают угнетение хемотаксиса, фагоцитоза и продукции супероксида нейтрофилами, а также угнетение презентации антигена дендритными клетками Т-клеткам. Избыточное потребление алкоголя подавляет функцию макрофагов [87].
Выше была описана важнейшая роль молекул холестерина в иммунном ответе. Марина Леонидовна Доценко дополняет, что высокое содержание холестерина в мембранах лимфоцитов необходимо для осуществления ими цитотоксических функций. Указывают на неспособность макрофагов к фагоцитозу микобактерий при нехватке холестерина и приходят к заключению, что гипохолестеринемия, наряду с курением и употреблением алкоголя, должна являться фактором риска заболеваний респираторного тракта.

У многих людей степень гипохолестеринемии можно расценивать как показатель иммунодефицитного состояния [88]. С точки зрения метаболомики в области липидных рафтов с внутренней поверхности мембраны клетки скапливаются и фиксируются для выполнения своей функции до 300 сигнальных молекул – передатчиков BCR. Весь этот огромный комплекс вместе с каждым рецептором получил название сигналосомы [89].
Ослабление работы сигналосом может привести не только к тяжелым исходам от банальной ОРВИ, но и к снижению контроля над ростом опухолей, при параллельном использовании гипохолестеринемических средств для «профилактики» атеросклероза. Нелишне напомнить, что холестерин настолько усиливает иммунный ответ против иммуногенов, что его используют в качестве адьюванта-усилителя в составе вакцин. К таким корпускулярным адьювантам относятся липосомы, синтетические двухслойные структуры, включающие холестерин и фосфолипид, способные инкапсулировать и транспортировать антигены. Иммуноген прирсоединяется к оболочке или инкорпорируется в межмембранное пространство липосом. Липосомы способствуют
продукции цитотоксических Т-лимфоцитов и презентации антигена [90].
Александр Исаакович Венгеровский пишет, что НПВС блокируют активацию лейкоцитов и хемотаксис их в зону воспаления, а также уменьшают выход цитокинов [91]. И это закономерно, потому что блокирование простагландинов уменьшает синтез металлопротеиназ (MMP), обеспечивающих проход дендритным клеткам из-под базальной мембраны в лимфатические сосуды и экстравазацию эффекторных клеток в место воспаления.
Т-клетки более чувствительны к апоптогенным факторам, нежели В-клетки, защищенные от апоптотической гибели экспрессированным на их мембране антигеном проонкогена Bcl. А апоптоз, как известно, является основным механизмом гибели клеток иммунной системы и развития иммунной недостаточности. Любые факторы, способные индуцировать процессы апоптоза Т-клеток (ионизирующее излучение, стрессы, повышение содержания глюкокортикостероидов и этанола, инфекция и др.), могут играть причинную роль в возникновении вторичного Т-клеточного иммунодефицита [92].
Избыток витамина D способствует иммунодепрессии: он препятствует дифференциации В-клеток и снижает продукцию антител [93]. Длительное применение аспирина, сульфаниламидных препаратов вызывает угнетение нейтрофилов и, как следствие, агранулоцитоз [94].
Список можно еще продолжить, но главное в профилактике иммуносупрессии – ограничить применение данных фармакотерапевтических средств строгими показаниями, либо заменить их использование безопасными методами традиционной медицины. В настоящее время в СМИ появилось новое понятие «постковидный синдром». Скорее всего, коронавирус редко является причиной. Чаще этот синдром возникает в результате фармакологических последствий, включая подавление клеточного иммунитета различными препаратами.
7.4. Поддержка клеточного иммунитета фитотерапией
С целью восстановления лимфопоэза Елена Евгеньевна Лесиовская рекомендует адаптогены: спирто-водные экстракты аралии высокой, жень-шеня обыкновенного, лимонника китайского, родиолы розовой, элеутерококка колючего и водные вытяжки из растений: травы астрагалов, листьев берёзы, травы горца птичьего, травы золотарника, листьев крапивы двудомной или жгучей, травы яснотки белой, травы майорана, травы шалфея.
С целью восстановления биоцидности фагоцитов доказательная фитотерапия применяет извлечения из растений, содержащих кремнийорганические соединения: горца птичьего, травы; клевера красного, травы; пырея ползучего, корней; репяшка аптечного, травы; и цинк-содержащих растений: плодов аниса,цветков бузины чёрной, корней имбиря, кукурузных рылец, травы коровяка скипетровидного, листьев лавра, травы мелиссы, травы с корнями сабельника болотного, травы или корневищ синюхи обыкновенной, листьев смоковницы, листьев смородины чёрной, травы шалфея. А также вытяжки из травы растений, содержащих полифенольные комплексы: зверобоя продырявленного, мелиссы лекарственной, фиалки трёхцветной, череды трёхраздельной.
Для улучшения функций естественных киллерных клеток используются извлечения из травы астрагалов, травы яснотки белой (крапивы глухой), корней лопуха большого, травы шлемника, травы фиалки трёхцветной, а для восстановления антигензависимой дифференцировки лимфоцитов вытяжки из слоевищ исландского мха (цетрарии), трав касатика болотного, листьев крапивы двудомной и жгучей, травы остролодочников, репяшка аптечного, шлемников, череды трёхраздельной. Для поддержки функций В-лимфоцитов применяются вытяжки из слоевищ исландского мха, травы овса молочной спелости, череды трёхраздельной, шлемника (виды), листьев эвкалипта шарикового [95].
Годовой алгоритм восстановления клеточного иммунитета.
Последователи лечения на новых биологических принципах по восстановлению энергетики клеток возвращают обеспеченность организма кислородом (любые посильные физические упражнения на свежем воздухе, ходьба, бег трусцой). Движение поможет улучшить рециркуляцию лимфоцитов и их обучение.
Рекомендуется простое, сбалансированное питание. Для верующих – без излишних строгостей в пост по ограничению белковой пищи. Белок холоднокровных животных полностью заменяет белок теплокровных в дни поста.
Лучше не мешать саногенезу приёмом выше описанных иммуносупрессоров, а также гипохолестеринемических средств и препаратов, усиливающих гипоксию. При большинстве хронических заболеваний целесообразно использование традиционных методов лечения.
Обычно используются следующие методологии назначения фитопрепаратов. Упрощённая схема включает применение адаптогенов с 15 августа по 15 апреля, как указано выше, плюс иммунных настоек с № 1 по № 13 (Монастырской аптеки Алифанов и Лес) по месяцу в течение года. В их состав входятспирто-водные экстракты корней имбиря, слоевищ исландского мха, корней калгана, коры с плодами калины, трав касатика болотного, травы овса молочной спелости, коры осины, травы остролодочника (виды), листьев смородины золотистой, травы фиалки полевой, череды трёхраздельной, шлемника (видов), яснотки белой. Иммунная настойка № 13 с чередой использовалась как замена иммунной № 3, так как шлемник, содержащийся в третьей, мог снижать артериальное давление слишком сильно. Кроме того, рекомендуются травяные чаи по месяцу: астрагала эспарцетного, бузины чёрной, репяшка аптечного, смородины золотистой, череды трёхраздельной, яснотки белой.
Более сложный алгоритм восстановления иммунитета либо по методике избавления от недуга дисбактериоза кишечника, часто болеющих детей, либо возвращения равновесия здоровья (ВРЗ) №1 и №2 по 6 месяцев. Для лечения ОРВИ в течение первой недели не рекомендуется использование синтетических препаратов, так как они являются в большинстве своём либо иммуносупрессорами, либо иммунодепрессантами. Использовалась методика избавления от недуга простуды.
Вышеприведенный текст является конспектом научной и учебной литературы. Собственные мысли автора обозначены курсивом, чтобы не навязывать мнение уважаемым читателям. Любой человек должен иметь возможность сверять данные науки с реальностью.
Основная литература
- Кокосов А.Н. Оздоровление организма: пути и возможности. – СПб., 2014.
- Scaiens News. Body’s bacteria don’t outnumber human cells so much after all https://www.sciencenews.org/article/bodys-bacteria-dont-outnumber-humancells-so-much-after-all
- Стома И.О. Виром в контекстве здоровья и патологии дыхательной системы человека. Проблемы здоровья и экологии, Гомель, 2022. – С. 8.
- Павленко В.И., Саяпина И.Ю. Клетки и органы иммунной системы. Учебное пособие. – Благовещенск, 2018. – С. 39.
- Снимщиков И.А. Курс лекций по общей иммунологии. – Орёл, 2015. – СС. 61-62.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – С. 321.
- Недоспасов С.А., Купраш Д.В., биофак МГУ. Иммунология. Лекции. – С. 10.
- Шатаева Л.К., Хавинсон В.Х., Ряднова И.Ю. Пептидная саморегуляцияживых систем (факты и гипотезы). – СПб., 2003. – С. 29.
- Полетаев А.Б. Иммунофизиология и иммунопатология (избранные главы). – М., 2008.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – СС. 263-264.
- Щубелко Р.В., Зуйкова И. Н., Шульженко А.Е. Мукозальный иммунитет верхних дыхательных путей. – Immunology. 2018; 39(1). – С. 87.
- Дранник Г.Н. Клиническая иммунология и аллергология. – М., 2003. – СС. 75–77, 84, 87.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – С. 17.
- Снимщиков И.А. Курс лекций по общей иммунологии. – Орёл, 2015. – С. 66.
- Лушова А.А., Жеремян Э.А., Астахова Е.А., Спиридонова А.Б., Бязрова М.Г., Филатов А.В. Субпопуляции В-лимфоцитов: функции и молекулярные маркеры Иммунология, том 40, № 6. – М., 2019. – С. 71.
- Талаев В.Ю., Талаева М.В., Воронина Е.В., Бабайкина О.Н. Миграция дендритных клеток in vitro, индуцированная вакцинами, стимулирующими гуморальный и клеточный иммунитет. Клиническая медицина. Т 8, № 3. DOI: 10.17691/stm2016.8.3.10
- Талаев В.Ю., Плеханова. М.В. Исследование миграции дендритных клеток и трафика антигенов в целях совершенствования средств иммунопрофилактики. – Медиаль № 2, май, 2014.
- Свешников К.А., Русейкин Н.С. Скорость движения лимфы в здоровой и травмированной конечностях. Современные проблемы науки и образования. – – № 2 – СС. 22-28 https://science-education.ru/ru/article/view?id=684
- Хаитов Р.М. Иммунология : учебник – М., 2018. – С. 33.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – СС. 24-27.
- Грищенко Е.А. Дендритные клетки: основные представления. Аллергология и иммунология в педиатрии № 2 (41) июнь 2015. – С. 15.
- Барычева Л.Ю. с соавт. Методические указания к практическим занятиям по дисциплине иммунология. СГМУ. – Ставрополь, 2021. Тема 6. Основы иммуногенетики.
- Стародубова Е.С., Исагулянц М.Г., Карпов В.Л. Регуляция процессинга иммуногена: сигнальные последовательности и их использование для создания нового поколения ДНК-вакцин Т. 2, № 1 (4), 2010. Acta naturae. – C. 63.
- Бурместер Г.Р., Пецутто А.. Наглядная иммунология / пер. с англ. – М., – С. 66.
- Аллергология и иммунология в педиатрии, № 1 (20), март 2010. – С. 6.
- Хаитов Р.М., Игнатьева Г.А. Наука об иммунитете – современные тренды. – М., 2023. – СС. 290-297.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – СС. 347-350.
- Хаитов Р.М., Игнатьева Г.А. Наука об иммунитете – современные тренды. – М., 2023. – СС. 297-298.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – СС. 275-280.
- Спирин А.С. Молекулярная биология. Рибосомы и биосинтез белка : учебное пособие. – М., 2023. – С. 12.
- Анушев В.Н.. Клиническая онкогематология, 2015. 8(1). МикроРНК: малые молекулы с большим значением.
- Комина А.В.1, 2, Лаврентьев С.Н.3, Рукша Т.Г. МикроРНК и малые интерферирующие РНК как инструменты направленной регуляции клеточных процессов для терапии онкологических заболеваний. Бюллетень сибирской медицины. 2020; 19 (1). СС. 162–171. https://ru.wikibrief.org/wiki/Small_interfering_RNA
- Львов Д.К. Руководство по вирусологии: вирусы и вирусные инфекции человека и животных. – М., 2013. – СС. 88-111.
- Фрейдлин И.С., Маммедова Дж. Т., Старикова Э.А. Роль аутофагии при инфекциях. Российский физиологический журнал им. И.М. Сеченова 2019, том 105, № 12. – С. 1496.
- Хаитов Р.М.. Иммунология : учебник – М., 2021. – СС. 176, 194.
- Супрун Е.Н. Рециркуляция лимфоцитов. Аллергология и иммунология в педиатрии, № 1 (36), март 2014.
- Гарсон Дасгупта А.К., Свешникова А.Н. Математическая модель образования кластеров рецепторов произвольного размера. Актуальные вопросы биологической физики и химии, 2019, том 4, № 3, сс. 374-377.
- Яковлева О.В., Яковлев А.В., Ситдикова Г.Ф. Аденилатциклазная и гуанилатциклазная системы. внутриклеточных вторичных посредников. Учебное пособие. Казань, 2009. – СС. 6, 18.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер. с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – СС. 31, 191.
- Улумбеков Э.Г., Челышева Ю.А. Гистология, эмбриология, цитология. – М., 2007. Глава 11.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – СС. 502-503.
- Сизякина Л.П., Харитонова М.В. Характеристика В2 лимфоцитов у пациентов с серопозитивным ревматоидным артритом суставной формы. Immunology. 2017; 37(4) – С. 227. https://applied-research.ru/ru/article/view?id=6638
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – С. 487.
- Афанасьев Ю.И., Юрина Н.А. Гистология, эмбриология, цитология : учебник / Ю.И. Афанасьев, Б.В. Алешин, Н.П. Барсуков (и др.) ;– М., 2021. – С. 531.
- Москалев А.В., Гумилевский Б.Ю., Апчел А.В., В.Н. Цыган Семейство В-лимфоцитов и их функции. Вестник российской военно-медицинской академии (67) – 2019. СС. 191-192.
- Хаитов Р.М., Игнатьева Г.А. Наука об иммунитете – современные тренды. – М.,2023. – СС. 258-265.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – С. 480.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – СС. 501, 508.
- Афанасьев Ю.И., Юрина Н.А. Гистология, эмбриология, цитология : учебник / Ю.И. Афанасьев, Б.В. Алешин, Н.П. Барсуков (и др.) ;– М., 2021. – СС. 520-521.
- Аббас А.К. Основы иммунологии. Функции иммунной системы и их нару-
шения : учебник / Аббас А.К., Лихтман Э.Г., Пиллан Ш.; пер с англ; научное ре-
дактирование перевода Р.М. Хаитова, Ф.Ю. Гариба. – М., 2022. – СС. 181-183. - Максимова Н.Е., Мочульская Н.Н., Емельянов В.В. Основы иммуноанализа. Учебное пособие. – Екатеринбург, 2021. – С. 18.
- Богачева Н.В. Спецглавы иммунологии. Словарь терминов. Учебно-методическое пособие. Киров, 2011. – С. 11.
- Криницкий А. А.Исследование иммуногенности и потенциальной протективности вакцины «ЭпиВакКорона» Группа добровольцев-исследователей вакцины «ЭпиВакКорона»1 и Участники 3 фазы клинических испытаний вакцины «ЭпиВакКорона» https://covid19-preprints.microbe.ru/files/299
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – СС. 502, 510.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – СС. 482-485.
- Грищенко Е.А. Дендритные клетки: основные представления. Аллергология и иммунология в педиатрии № 2 (41) июнь 2015. – С. 15.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – С. 512.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – СС. 415-421.
- Дэнс, Эмбер. Основная концепция: Клетки грызут друг друга посредством недооцененного процесса трогоцитоза. Доклад Natl Academy Sci USA. V.116 (36); 3 сентября 2019 https://translated.turbopages.org/proxy_u/en-ru.ru.3a941d5a-65a12f48-7575826a-74722d776562/https/www.ncbi.nlm.nih.gov/pmc/articles/PMC6731757/
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – СС. 423-424.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – СС. 504-523, 526-529, 566-567.
- Медуницын Н.В. Вакцинология: монография / Н.В. Медуницын,А.В. Катлинский, Л.О. Ворслов. – М., 2022. – СС. 129,153, 236.
- https://www.vidal.ru/drugs/molecule/1882
- Киселевский М.В.1, Чикилева И.О.1, Ситдикова С.М. 1, Власенко Р.Я.1, Караулов А.В.2. Перспективы применения генетически модифицированных лимфоцитов с химерным Т-клеточным рецептором (CAR-T-клеток) для терапии солидных опухолей Иммунология, том 40, № 4. – М., 2019. – С. 52.
- Козлов В.А., Савченко А.А., Кудрявцев И.В., Козлов И.Г., Кудлай Д.А., Продеус А.П., Борисов А.Г., Клиническая иммунология. – Красноярск, 2020. – СС. 65-66.
- Таганович А, Ковганко Н, Таганович Н. Роль хемокинов в патогенезе и течении немелкоклеточного рака легкого. Бомаркеры в клинической практике. Наука и инновации, апрель 2019, №4 (194) Беларусь. – С. 21.
- Козлов В.А., Савченко А.А., Кудрявцев И.В., Козлов И.Г., Кудлай Д.А., Продеус А.П., Борисов А.Г., Клиническая иммунология. – Красноярск, 2020. – СС. 64,70.
- Пальчун В.Т. Оториноларингология : национальное руководство. – М, – С. 51.
- Шабашова Н.В. Иммунитет, иммунная система и профилактика инфекционных и неинфекционных заболеваний. – СПб., 2016. – СС. 20-21.
- Яковлев С.В. Рациональная антимикробная терапия: руководство для практикующих врачей. – М., 2015. – СС. 35.
- Зверев В.В. Медицинская микробиология, вирусология и иммунология. В 2 т. Том 1 : учебник / Под ред. В.В. Зверева, М.Н. Бойченко – М., 2016. – С. 233.
- Мерфи К., Уивер К. Иммунобиология по Джанвэю / пер с англ. под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – СС. 502-503, 514.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – СС. 497-505.
- Шабашова Н.В. Вторичный иммунодефицит (причины, иммунопатогенез, клинические признаки, профилактика и лечение. – СПб., 2023. – С. 8.
- Аббас А.К. Основы иммунологии. Функции иммунной системы и их нарушения : учебник / Аббас А.К., Лихтман Э.Г., Пиллан Ш.; пер с англ; научное редактирование перевода Р.М. Хаитова, Ф.Ю. Гариба. – М., 2022. – СС. 34-36. Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., 2021. – С. 48.
- Найхин А.Н., Кореньков Д.А., Петухова Г.Д., Чиркова Т.В., Григорьева Е.П., Руденко Л.Г. Оценка Т-клеточной иммунологической памяти при экспрессии молекул CD45+ у людей, привитых живой реассортантной гриппозгной вакциной. Медицинская Иммунология 2008, Т. 10, № 6, стр. 535-542 (вирусная).
- Бриньольффсон Сиггейр, Мохаддес Мазиар, Karrholm Johan и Джо-Вик Мери. Долгоживущие плазматические клетки в костном мозге человека могут быть либо CD19+, либо CD19- National Library of MedicinePMC5727810 23 мая 2017
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – С. 488.
- Лушова А.А., Жеремян Э.А., Астахова Е.А., Спиридонова А.Б., Бязрова М.Г., Филатов А.В. Субпопуляции В-лимфоцитов: функции и молекулярные маркеры Иммунология, том 40, № 6. – М., 2019. – С. 70.
- Недоспасов С.А., Купраш Д.В. Иммунология по Ярилину : учебник. – М., – С. 414.
- Газатова Н. Д., Юрова К. А., Тодосенко Н. М., Вульф М. А., Литвинова Л. С. Роль иммунных реакций в гомеостазе и патологии печени. Цитология, 2019, T. 61, № 3. – Калининград. – СС. 185-197.
- Супотницкий М.В. Феномен антигенного импринтинга в эпидемических, инфекционных и поствакцинальных процессах. Биопрепараты, июль-сентябрь, – СС. 28-36.
- Сахаров В.Н., Литвицкий П.Ф. Нестабильность конформации белка – общий компонент патогенеза болезней человека. Актуальные вопросы патофизиологии. Вестник РАМН /2016/ 71 (1) – СС. 47-50.
- Сургучёв А., Сургухов Конформационные заболевания: взгляд в глаза. А. Brainresbull. 15 января 2010;81(1):12-24. doi: 10.1016/j.brainresbull.2009.09.015. https://translated.turbopages.org/proxy_u/en-ru.ru.9ba13b33-65aa4c78-c604f40b-74722d776562/https/pubmed.ncbi.nlm.nih.gov/19808079/
- Иллариошкин С.Н. Конформационые болезни мозга. –М., 2003.
- Нейтропении: старая проблема – новое прочтение. Советы гематолога кардиологу. Черепанова В.В., Михайлова З.Д., Михайлова Ю.В., Синькова В.В. Кардиология: новости, мнения, обучение. Том 7, №1, 2019.
- Спикетт Гэвин. Клиническая иммунология и аллергология: оксфордский справочник. Пер с англ. под ред. Н.И. Ильиной. – М., 2022. – СС. 215, 702, 718, 758.
- Доценко М. Л. Холестерин и иммунитет: клинико-иммунологические параллели. – Наука и инновации, апрель, 2015.
- Хаитов Р.М., Игнатьева Г.А. Наука об иммунитете – современные тренды. – М.,2023. – С. 330.
- Козлов В.Г., Ожерелков С.В., Санин А.В., Кожевникова Т.Н. Адьюванты в современной медицине и ветеринарии. Журнал микробиологии, № 1. – М., – СС. 94-95.
- Венгеровский А.И. Фармакология: учебник.– М., 2020. – С 631.
- https://journal.giduv.com/numbers/2008/2/15
- Снопов С.А. Механизмы действия витамина D на иммунную систему. Медицинская иммунология 2014, Т. 16, № 6. – С. 507 https://istina.msu.ru/ profile/SnopovSA/
- Кузнецов А. П. Основы иммунитета и ВИЧ-инфекция : монография /
А.П. Кузнецов, Л. Н. Смелышева, Н. В. Сажина, О. А. Архипова. – Курган. – С. 59. - Лесиовская Е.Е. Доказательная фитотерапия. Руководство для врачей и провизоров – СПб., 2019. Т 1. – СС. 140-146.