08. Порядок антителообразования
Антитела — это иммуноглобулины, которые по своей структуре являются белками иммунной системы, свернутыми в клубочки-глобулы1 третичной структуры в пространственном стреохимическом описании. Выдающийся иммунолог профессор Александр Борисович Полетаев
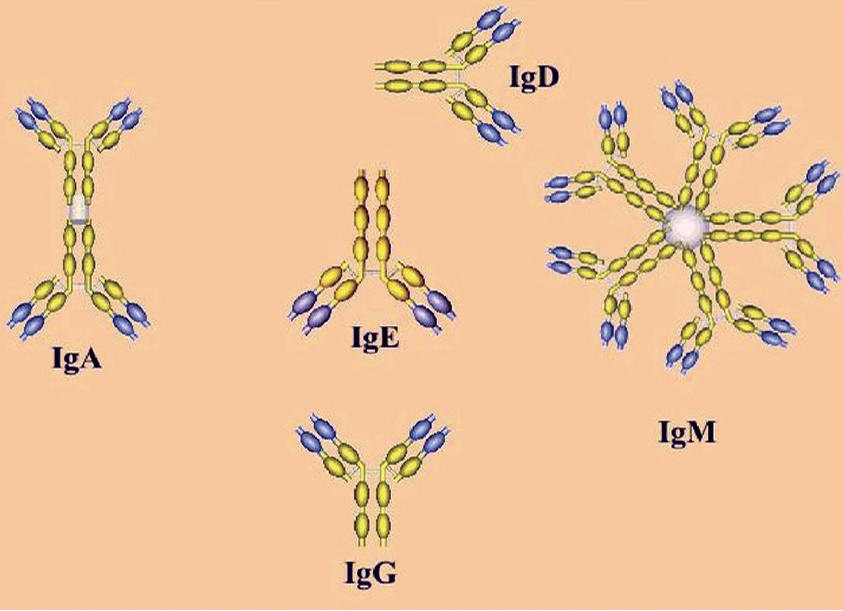
писал, что антитела циркулируют не только в крови, они вездесущи – в секретах органов, в тканевых жидкостях, антитела даже проникают внутрь клеток, внутрь «святая святых» – ядер клеток и выполняют такое множество функций, которые наука описала далеко не полностью2. Защита от инфекций – лишь один из примеров их регуляторной функции. Количество циркулирующих белков в плазме крови у взрослых 65–85 грамм на литр. Среди них – альбумины, глобулины и фибриноген. Среди глобулинов гамма-глобулины включают в себя антитела, это 5 классов иммуноглобулинов: IgG, IgA, IgD, IgM, IgE3.
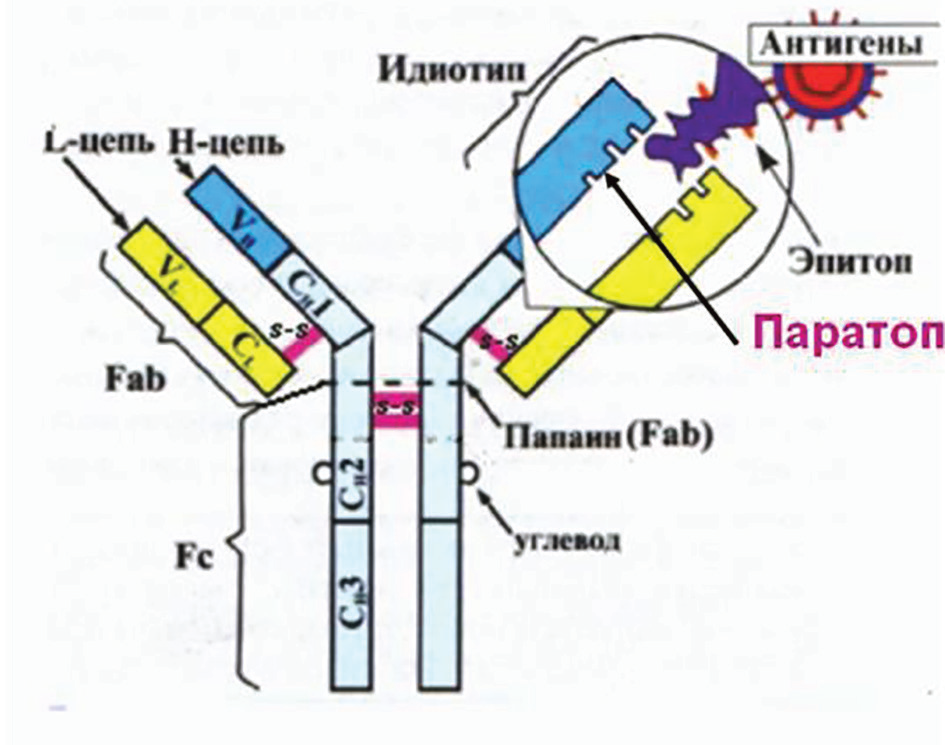
Конфигурация антител представляет собой мономеры, одинарные молекулы с одной двойной цепью IgG, IgA, IgD, IgE, димеры с двумя двойными цепями – секреторные sIgA и пентамеры с пятью двойными цепями – IgM. (Конфигурация – это то, что неизменно, конформация – то, что меняется – АА). Молекула иммуноглобулина по своей структуре напоминает «рогатку»4.
Микробы и вирусы, постоянно присутствующие на поверхности слизистых, стимулируют образование неспецифических (против всех «чужаков» – АА) антител, поэтому макроорганизм уже в первые минуты контакта всегда готов к отражению атаки любых антигенов. Академик Рахим Мусаевич Хаитов сообщает, что предназначение В1-лимфоцитов – быстрый ответ на проникающие в организм патогены. Они постоянно производят спонтанную секрецию антител. Ещ¸ до встречи с каким бы то ни было внешним антигеном в крови и биологических жидкостях организма уже присутствуют так называемые естественные (конститутивные) иммуноглобулины A, M, G. Они способны перекрестно связывать множество антигенов, включая аутоантигены. Естественные антитела (их чаще называют «нормальные иммуноглобулины») являются «первой линией обороны» против патогенов, в том числе они удаляют из организма погибшие клетки и продукты жизнедеятельности, нейтрализуют бактериальные токсины и собственные вирусы, микробы и
грибки, предохраняют от излишнего повреждения собственных тканей системой комплемента – в общем, поддерживают гомеостаз. И важнейшее их свойство – обеспечивают длительную иммунологическую память к ряду микррорганизмов5. В миндалинах и в кишечнике человека на долю Ig-образующих клеток приходится до 90% клеток, производящих антитела. Ig- антитела образуются в мукозальном (слизистом) отделе иммунной системы как местно, на периферии (под влиянием местных факторов), так и во вторичных лимфоидных органах, откуда они мигрируют в слизистые оболочки6.
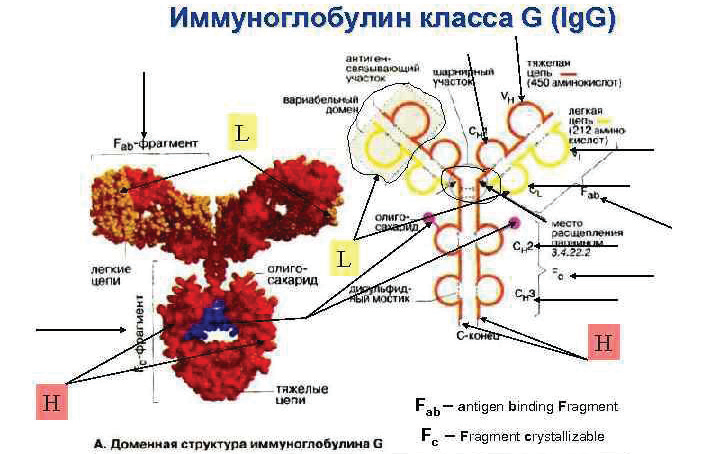
Мономер антитела состоит из двух частей: 1. Фрагмент белка в виде стабильного Fc (Fragment constant), который во время иммунного процесса прикрепляется к строго заданным рецепторам макроорганизма хозяина «ножкой», С-концом. 2. «Ручками» антитело захватывает патоген, они называются Fab, фрагментами антиген-захватывающими (Fragment antigen binding). Fab похожи на латинскую букву V, – их еще называют сверхизменчивыми, гипервариабельными (HV, Hyper-Variable) так как они вертятся на шарнирах и готовы «ухватить» почти любую цель. Эти изменчивые фрагменты белковой молекулы антитела приспосабливаются к выступам-эпитопам антигена, меняют свое пространственное расположение, или конформацию. Поэтому их участки еще называют предназначенными к соответствию – CDR (Complementarity-Determing Region)7. Двойной захват антигена гораздо прочнее, чем только одним антиген связывающим участком. Аффинность означает прочность связываний антиген-антитело в одном участке белков, авидность – это суммарная прочность связи множества контактов. Связь антиген-антитело определяют электростатикеские, ионные, водородные, гидрофобные (водоотталкивающие) силы и связи электронных облаков8.
Активные центры связывания с эпитопами (выступами) антигенов называются паратопами (впадинами) от греч. Para – около, topos – место Конфигурация паратопа зеркально отражает стереометрию эпитопа в результате синтеза антител под влиянием различных стимулов процесса иммунизации. Образно говоря, они подходят друг к другу как ключ к замку. Антитела связываются с
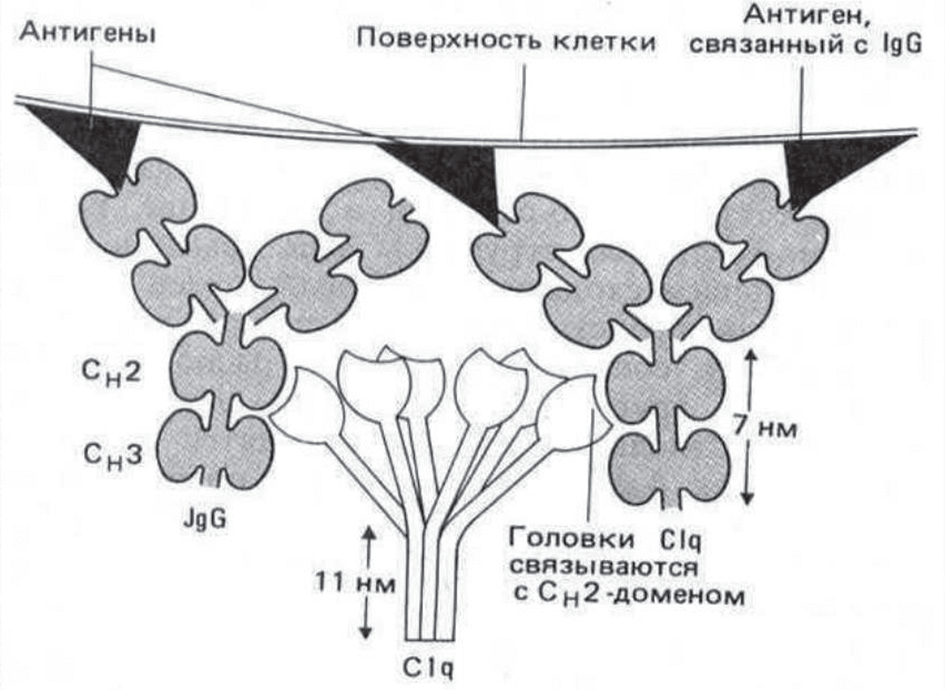
антигенами за счет электростатических (ионных и полярных сил) на очень малом расстоянии в доли нанометра и при взаимодействии электронных оболочек атомов9. После связывания антигена, например, вируса, «ручками» антитела Fab, конформация иммуноглобулина меняется, в результате чего в его «ножке» Fc открывается участок, который связывается с концами «ветвей букета» молекулы системы комплемента C1q, которые в крови циркулируют постоянно, после чего начинается каскад цепных реакций агрессивных белков системы комплемента, описанный нами в разделе 2.4. и вирус уничтожается10. Уничтожается также и вирус-пораженная клетка.
Кроме вовлечения системы комплемента, после секреции плазматическими клетками, антитела блокируют патогены непосредственно, напрямую, либо блокируют продукты их жизнедеятельности – токсины, путем связывания с ними. Просто связываясь с токсином или с вирусом, антитело может препятствовать распознаванию их рецепторами клеточной поверхности. Для этого достаточно V-областей антител. Однако для привлечения других клеток и молекул, уничтожающих и удаляющих патогены, с которыми связалось антитело, необходима С-область. В третьем варианте защитных действий – после захвата патогена «ручками» Fab, антитела другим фрагментом, С-концом, «ножкой» Fc, связываются с рецепторами нейтрофилов или макрофагов11. Как пишут профессора Герд-Рюдигер Бурместер и Антонио Пецутто, начинает
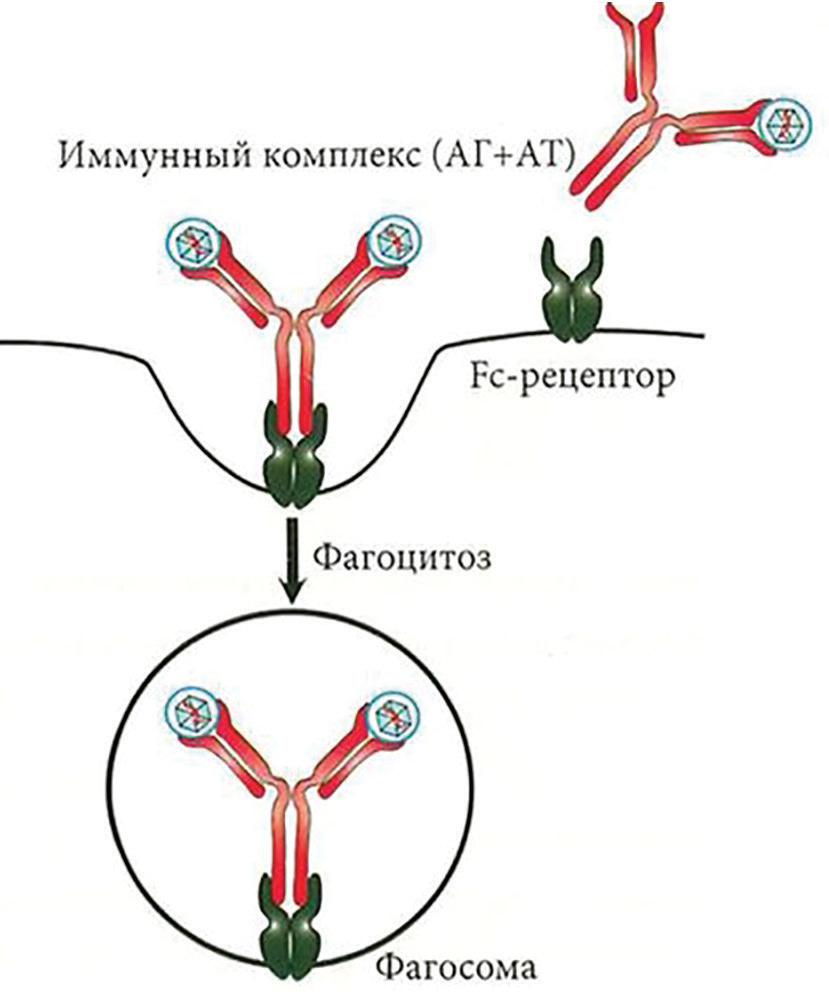
происходить Fc-опосредованный фагоцитоз, когда через рецепторы FcR с помощью энергии АТФ передаются сигналы внутрь клетки хозяина, и развивается каскад внутриклеточных реакций, появляются нити актина, внутрь прогибается мембрана, формируется фагоцитарная чаша и так далее12.
Таким образом, антитела «метят» патогены, помеченные патогены распознаются FcR-рецепторами фагоцитов, связываются с «торчащими ножками» антител и «пожираются» ими (греч. φαγεῖν пожирать + κύτος клетка). Но система комплемента тоже «ставит черную метку» и активирует фагоцитоз.
Эти два метчика при совместной работе еще сильнее опсонизируют патогены. При эксперименте в пробирке после введения антител выживаемость микроорганизмов уменьшалась в 100 раз, а после введения белков системы комплемента выживаемость уменьшалась еще в 100 раз13. Таким образом, подавление выживания патогенов в 10 000 раз абсолютно подавляет инфекционный процесс.
Шарнирная область антитела состоит в основном из остатков цистеина, вовлекающегося в образование дисульфидной связи SS и пролина, обеспечивающего гибкость и предотвращающего сворачивание в глобулу всей молекулы антитела. Это позволяет Fab-фрагментам, именуемым нами
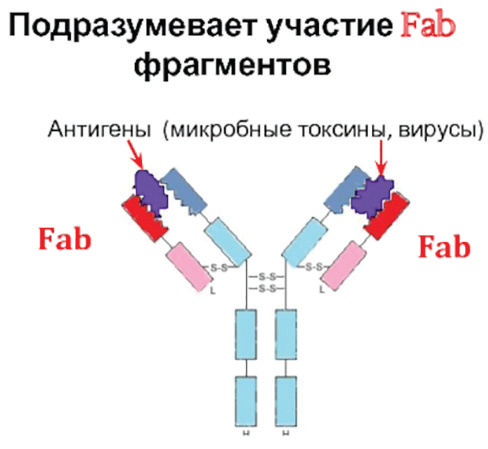
«ручки», открываться и закрываться, чтобы обеспечивать связывание с двумя эпитопами патогена14. У антител IgM, IgE участок шарнирной области построен по-другому, но все равно «ручки» Fab могут изгибаться относительно «ножки» Fc15. Активный центр иммуноглобулинов как антигенсвязывающий участок представляет собой канал длиной 6 нанометров и шириной 1,2–1,5 нм, площадь поверхности, предназначенной для контакта с антигеном, составляет около 7,2 нм2 участка16. Чем ближе молекулы, тем сильнее химическая энергия притяжения либо отталкивания.
Профессор Георгий Николаевич Дранник подтверждает, что в организме еще до появления того или другого антигена существуют клоны В-лимфоцитов, которые способны продуцировать разнообразные по специфичности иммуноглобулины. Синтез антител происходит постоянно и в определенной степени не зависит от действия конкретного антигена. При попадании в организм любого антигена (бактерии, вирусы, растворимые антигены и др.) ему в циркулирующей крови немедленно противостоят эти естественные антитела. Иммуноглобулин, входящий в состав
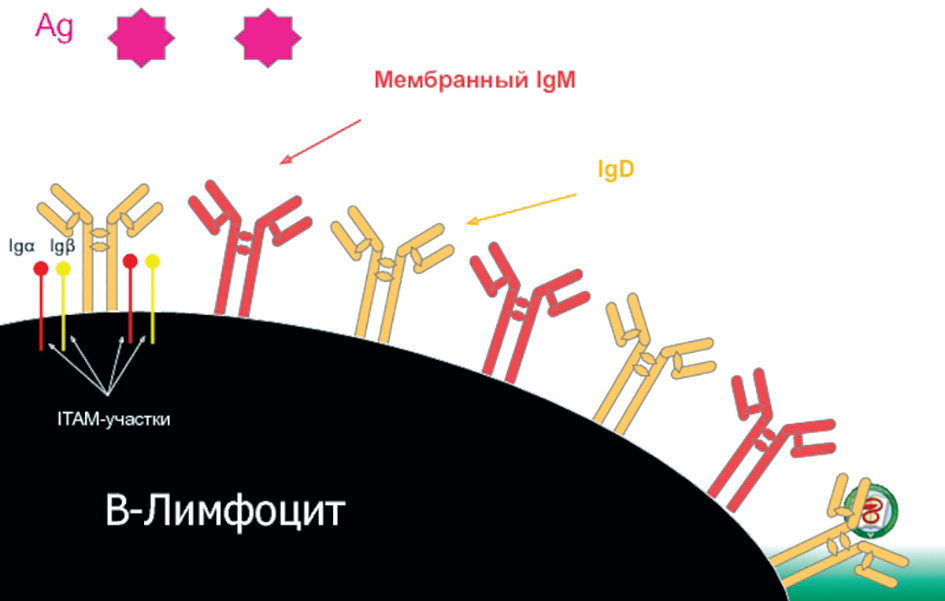
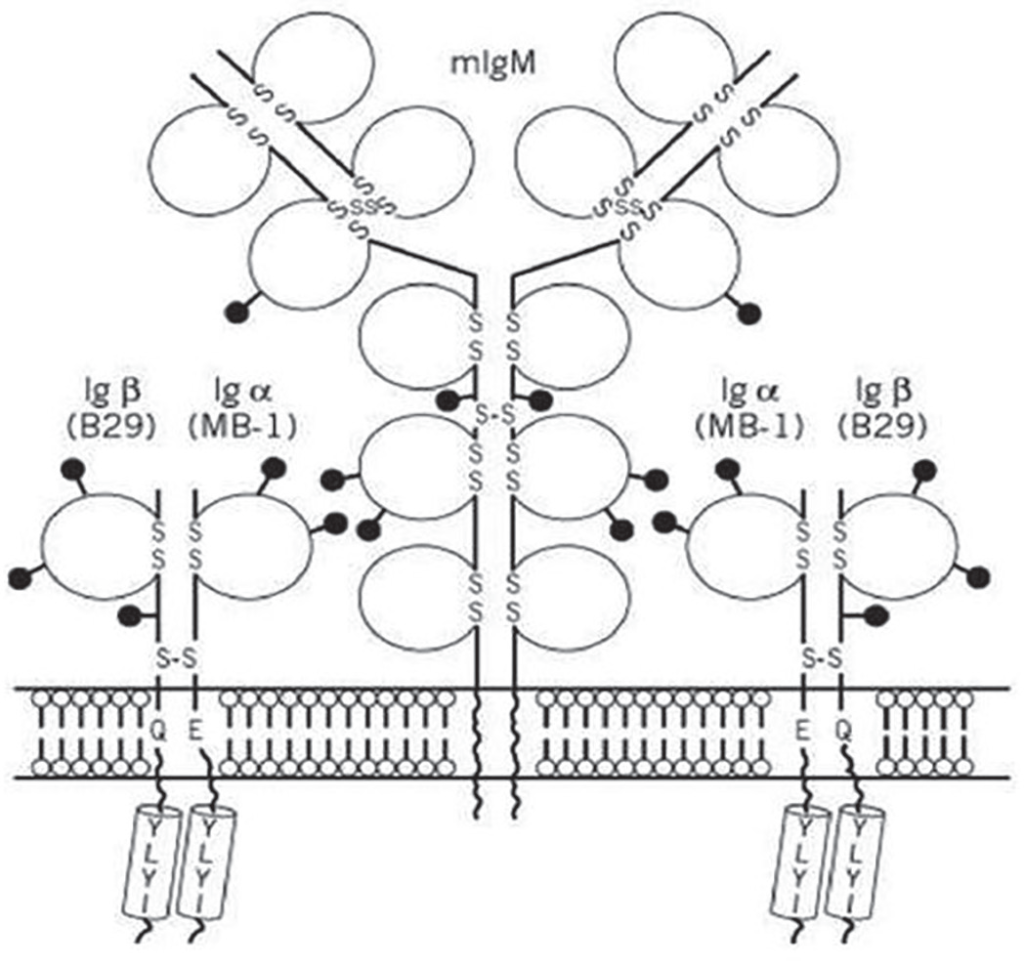
иммунного комплекса, активирует систему комплемента, фагоцитоз, что приводит к разрушению антигена. Так В-лимфоциты участвуют в работе врожденного иммунитета. Кроме того, часть патогенов связывается с рецепторами BCR на В-лимфоцитах в виде встроенных в мембрану антител IgM и IgD. Установлено, что в течение 5–6 дней, которые уходят на развитие первичного иммунного ответа без участия специфически обученных Т-лимфоцитов, образуется клон В-клеток, которые в течение одного дня продуцируют до 100 триллионов антител IgM, специфических к данному патогену, если он обладает повторяющимися антигенными детерминантами. Однако иммунологическая память IgM-антителозависимого ответа отсутствует.
Грамотрицательные микробы (например, все возбудители кишечных инфекций) вызывают выработку только IgM без последующего образования клеток иммунологической памяти. Поэтому вакцинация не дает длительного результата. Являясь слабоспецифичными, IgM могут связывать сразу пять молекул антигена. Это ведут к образованию крупных иммунных комплексов и способствует более быстрому выведению антигенов из циркуляции, а также предотвращает возможность их прикрепления к клеткам и инициации патологического процесса. Подсчитано, что
агглютинирующая и комплементсвязывающая способности IgM в сотни раз активнее, чем у IgG. Следует помнить, что некоторая часть IgM продуцируется локально и относится к секреторным17. Профессора Кеннет Мерфи и Кейси Уивер вполне согласны с тем, что IgM намного эффективнее IgG в активации системы комплемента18.
Зрелый наивный В-лимфоцит несет на своей мембране рецепторы BCR в виде двух типов антител IgD и IgM. Еще в эмбриональном периоде В1-клетки мигрируют из костного мозга в периферические ткани – преимущественно в серозные полости легких и кишечника, где они потом существуют в течение всей жизни организма. Кроме антимикробного действия, когда рецепторы IgD активируют лимфоциты к ответу19, они подавляют излишнюю агрессивность аутореактивных В-клеток, переводя их в неактивное состояние. На каждом В лимфоците сосредоточено около 150 000 BCR20.
Академик Рахим Мусаевич Хаитов также сообщает, что вся совокупность В-лимфоцитов организма способна синтезировать огромное разнообразие специфичностей антител – от миллиона до миллиарда. Однако точно установить, сколько разных антигенов потенциально способно связаться с одним антителом, принципиально невозможно21.
Академик Сергей Артурович Недоспасов и член-корр. РАН Дмитрий Владимирович Купраш указывают, что В1-клетки превращаются в антителообразующие клетки и без стимуляции антигеном. При этом они продуцируют антитела в основном IgM и IgA с полиспецифичностью (против всех «чужаков» – АА). В организме они обеспечивают присутствие предсинтезированных полиспецифичных антител (нормальных иммуноглобулинов). При проникновении патогена во внутреннюю среду организма эти антитела реагируют с ними. Образуются иммунные комплексы, они связывают систему комплемента и обеспечивают фагоцитоз. Их защитная роль достаточно велика, поскольку она реализуется в самый ранний срок после инфицирования, кстати, пентраксины, параллельно выполняющие аналогичную роль, обладают еще меньшим сродством к патогенам. (см. гл. 3). Одной из функций естественных антител является поддержание тканевой целостности и гомеостаза. Они способствуют удалению апоптотических и некротических клеток, связываясь с ними, привлекая фагоциты. Это ограничивает тканевое воспаление и препятствует возникновению аутоиммунной патологии22.
Размышляя о первой седмице простуды и противовирусной иммунной защите, в настоящем конспекте мы мало времени уделяем антителам IgE, которые также активируют противомикробный, противопаразитарный иммунитет и опосредуют аллергические реакции23. Другие антитела для противовирусной защиты более важны.
Для ткани слизистой оболочки полости носа и околоносовых пазух свойственно строение, присущее структурам, обеспечивающих реакции иммунного ответа и содержащих обширное количество IgA – продуцирующих клеток. Типичным ответом на длительное повреждение
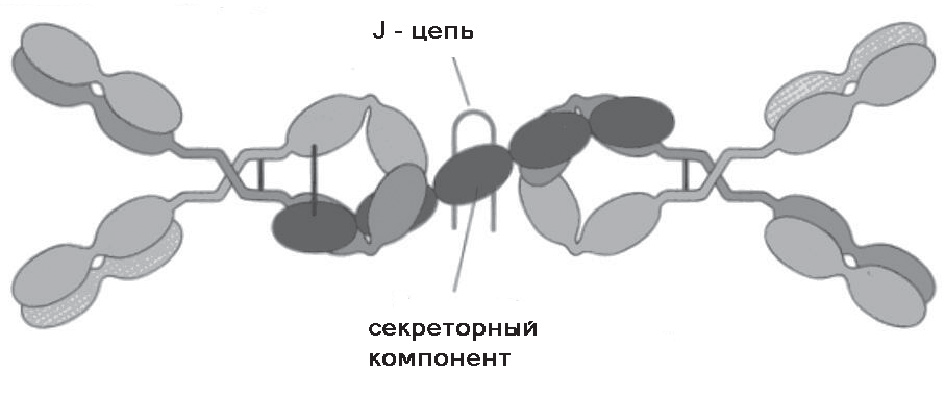
слизистой оболочки является усиление продукции назального секрета параллель- но с увеличением образования IgA24. А его даже у здоровых людей выделяется от 100 мл до 2 л в сутки25. Секреторные антитела sIgA могут прикрепляться к слизистой оболочке секреторным компонентом, они находятся также в слюне, пищеварительном тракте, секрете бронхов, грудном молоке. sIgA подавляют прикрепление микробов к слизистой оболочке, обладают мощной противовирусной активностью26.
Иммуноглобулины класса А имеются в крови и секретах слизистых оболочек всегда. В сыворотке крови содержится около 2 г/л IgA. В крови IgA присутствуют в виде мономеров, одинарных молекул, а в секретах в форме димеров, сдвоенных молекул. Димеры характеризуются наличием дополнительной J-цепи, сшивающей два мономера в районе Fc-фрагмента, и секреторного компонента, который присоединяется к IgA в эпителиальной клетке. Секреторный компонент (гликопротеид) обеспечивает прохождение IgA через эпителиальную клетку и защиту его от расщепления протеолитическими ферментами секретов. Секреторные IgA (sIgA), будучи антителами, формируют местный иммунитет, препятствуют прикреплению микроорганизмов к эпителию слизистых оболочек, метят микробные клетки, усиливают фагоцитоз. Кроме этого, они препятствуют поглощению и репродукции вирусов в клетках эпителия. Ежедневно в кишечнике синтезируется до 3 г секреторного IgA. Новорожденные получают секреторный IgA с молоком матери27.
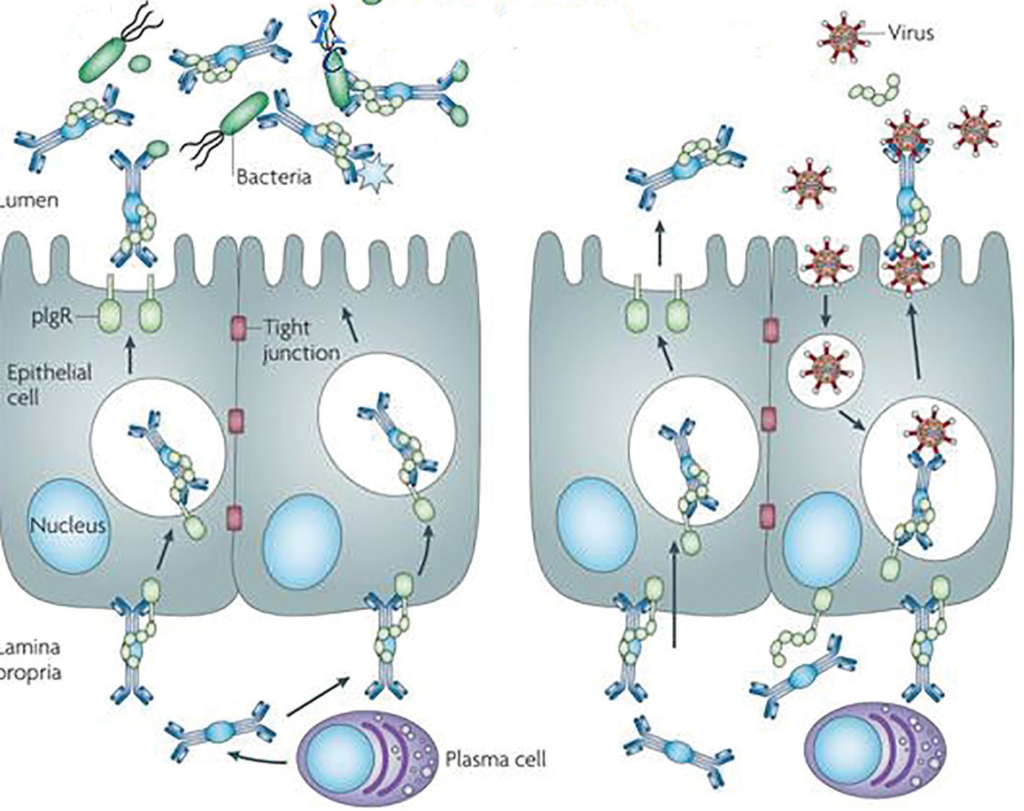
компонент препятствует разрушению антител sIgA на поверхности слизистых оболочек. В.Т. Пальчун, 2020.
Итак, нейтрализация вируса препятствует его прикреплению к клетке-мишени: опосредуется антителами IgG во внеклеточной жидкости, IgM в крови и слизистых и секреторными антителами IgA на поверхности слизистых оболочек. Интересно, что часто противоВирусный иммунный ответ не является воспалительным, носит асептический характер, даже происходит без антител, например, одним только комплементом и т.д.28 И это не зависит от видов вирусов, потому что высокоспецифический иммунитет к данному актуальному возбудителю возникнет лишь к концу седмицы. Благодаря противовирусной защите врожденного иммунитета мы почти никогда не замечаем циркуляцию вирусов среди окружающих нас людей. Например, известно, что антитела актуального штамма гриппа ежегодно обнаруживают у 70–80% людей29, при числе заболеваний гриппом нескольких процентов населения каждый год30. Это означает, что вирусоносительство гриппа большинство населения даже не чувствует. Подробнее мы рассматривали вопросы здорового вирусоносительства в 2021 году31.
Академик Сергей Артурович Недоспасов и член-корр. РАН Дмитрий Владимирович Купраш подводят итог. – Одна молекула различных антигенов, включая капсидные белки вирусов, с повторяющимися идентичными эпитопами, связывается со многими BCR и вызывает их активацию и образование антител M, G, A классов. Распространенные компоненты многих патогенов обладают способностью автономно активировать В-лимфоциты при минимальном участии вспомогательных клеток. Их называют Т-независимые антигены. Особенно при большой концентрации эти антигены становятся способны активировать все В-клетки, независимо от специфичности их BCR. Таким образом, нельзя исключить, что ряд иммунологических постулатов претерпит значительные изменения в ближайшее десятилетие. Вероятно, антигеннезависимая стимуляция В-клеток вносит вклад, возможно решающий, в индукцию образования при иммунном ответе антигеннеспецифических антител, доля которых может превышать долю специфических антител. Спонтанный (независимый от поступления антигена) синтез иммуноглобулинов характеризует В1-лимфоциты32. И зарубежные коллеги профессора Кеннет Мерфи и Кейси Уивер делают подобное умозаключение: общий репертуар антител любого организма достаточно велик, что гарантирует распознавание практически любой антигенной структуры33.
Источники
- Медицинская микробиология и иммунология: Учебник / В.Н. Мальцев, Е.П. Пашков; под ред. В.В. Зверева. – М., 2014. – С. 183.
- Полетаев А.Б. Иммунофизиология и иммунопатология (избранные главы). – М., 2008. – С. 20.
- Орѐл, Н. М. Функциональная биохимия: пособие. В 2 ч. Ч.1. Функциональная биохимия крови, печени, почек, мышц /Н. М. Орѐл. – Минск: БГУ, 2015.
- Медицинская микробиология и иммунология: Учебник / В.Н. Мальцев, Е.П. Пашков; под ред. В. В. Зверева. – М., 2014. – С. 183.
- Иммунология: учебник / Р.М. Хаитов. – М., 2021. – С. 170–171.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 530.
- Иммунология. Атлас. / Р.М. Хаитов, Ф.Ю. Гариб. – М., 2020. – С. 134, 138.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 260, 297,298.
- Медицинская микробиология и иммунология: Учебник / В.Н. Мальцев, Е.П. Пашков; под ред. В. В. Зверева. – М., 2014. – С. 184.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 186.
- Иммунобиология по Джанвэю / К. Мерфи, К. Уивер; пер с англ.; под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – С. 237, 496.
- Наглядная иммунология / Г.-Р. Бурместер, А. Пецутто; пер с англ. – М., 2020. – С. 50–51. Мы опишем фагоцитоз подробнее в главе об иммунных клетках.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 491.
- Структура антител и их функции
- Иммунобиология по Джанвэю / К. Мерфи, К. Уивер; пер с англ.; под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – С. 237.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 260.
- Дранник Г.Н. Клиническая иммунология и аллергология. – М., 2003. – С. 75–77, 84, 87.
- Иммунобиология по Джанвэю / К. Мерфи, К. Уивер; пер с англ.; под ред. Г.А. Игнатовой, О.А. Синтич, И.Н. Дьякова. – М., 2020. – С. 535.
- Рабсон А., Ройт А., Делвз П. Основы медицинской иммунологии: Пер с англ. – М., 2006. – С. 54.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 262–263, 331–333.
- Иммунология: учебник / Р.М. Хаитов. – М., 2021. – С. 146.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 333, 510.
- Рабсон А., Ройт А., Делвз П. Основы медицинской иммунологии: Пер с англ. – М., 2006. – С. 54,59.
- Исаченко Вадим Сергеевич. Методологический подход к коррекции мукоцилиарного клиренса слизистой оболочки в комплексном лечении патологии носа. Диссертация на соискание ученой степени доктора медицинских наук. – СПб, 2020.
- Основные компоненты назального секрета. Мукоактивные средства во врачебной практике. Н.Л. Кунельская, А.В. Артемьева-Карелова. Лечебное дело, 3. – 2013.
- Клиническая иммунология. Учебник для студентов медицинских вузов / Под ред. А.В. Караулова. – М., 1999. – С. 18.
- Д.К. Новиков. Медицинская иммунология: учебное пособие для студентов медицинских вузов. – Витебск, 2002. –С. 48.
- Дранник Г.Н. Клиническая иммунология и аллергология. – М., 2003. – С. 211.
- Математические модели в иммунологии и эпидемиологии инфекционных заболеваний / А.А. Романюха. – М., 2015. – С. 4.
- Д.А. Лиознов Достижения и проблемы борьбы с гриппом. СПб, 2016.
- Избавление от недугов». Том IV. Смерть при ковид-19: расследование / А.А. Алифанов. – СПб., 2021.
- Иммунология по Ярилину: учебник / под ред. С.А. Недоспасова, Д.В. Купраша. – М., 2021. – С. 333, 510–512.
- Иммунобиология по Джанвэю / К. Мерфи, К. Уивер; пер с англ.; под ред. Г.А. Игнатовой, О.А.Синтич, И.Н. Дьякова. – М., 2020. – С. 174.